§ 11. Тэрмадынамічная сістэма. Унутраная энергія. Унутраная энергія ідэальнага аднаатамнага газу
| Сайт: | Профильное обучение |
| Курс: | Фізіка. 10 клас |
| Книга: | § 11. Тэрмадынамічная сістэма. Унутраная энергія. Унутраная энергія ідэальнага аднаатамнага газу |
| Напечатано:: | Гость |
| Дата: | Воскресенье, 6 Июль 2025, 08:52 |
Поўную энергію фізічнай сістэмы можна выразіць як алгебраічную суму яе механічнай энергіі і ўнутраных энергій цел, якія ўтвараюць сістэму. Змяншэнне механічнай энергіі сістэмы ў шэрагу выпадкаў адбываецца пры самаадвольным пераходзе яе часткі ва ўнутраную энергію цел сістэмы. Так, напрыклад, рэжучыя інструменты прыкметна награваюцца пры завострыванні. Падчас бегу канькабежца пад канькамі растае лёд, што забяспечвае добрае слізганне. У гэтых прыкладах целы пры трэнні награваюцца, і інтэнсіўнасць цеплавога руху іх малекул узрастае, што прыводзіць да павелічэння ўнутранай энергіі цел. Як жа вызначыць унутраную энергію тэрмадынамічнай сістэмы? І што разумеюць пад тэрмадынамічнай сістэмай?
Тэрмадынамічная сістэма. У тэрмадынаміцы фізічныя целы і іх мадэлі называюць тэрмадынамічнымі сістэмамі. Для іх апісання выкарыстоўваюць параметры сістэмы, такія як ціск, аб’ём, тэмпература (макрапараметры), а не фізічныя характарыстыкі малекул (мікрапараметры). Макрапараметры можна непасрэдна вымераць з дапамогай прыбораў або выразіць праз іншыя велічыні, якія можна вымераць доследным шляхам. Мы разгледзім найбольш простыя тэрмадынамічныя сістэмы, стан якіх вызначаюць, выкарыстоўваючы толькі ціск, аб’ём і тэмпературу.
Целы, якія ўтвараюць тэрмадынамічную сістэму, могуць абменьвацца з навакольным асяроддзем энергіяй, а таксама рэчывам. Калі гэтага не адбываецца, то тэрмадынамічную сістэму называюць замкнутай або ізаляванай.
![]()
Ізаляваная тэрмадынамічная сістэма імкнецца да раўнавагі, калі ўсе яе макрапараметры не змяняюцца з цягам часу. Інакш кажучы, для кожнай ізаляванай тэрмадынамічнай сістэмы існуе стан тэрмадынамічнай раўнавагі, у які яна пераходзіць самаадвольна.
Гэтае сцвярджэнне называюць нулявым пачаткам тэрмадынамікі*.
У адным выпадку газ знаходзіцца ў герметычна закрытай цепланепранікальнай пасудзіне, а ў другім — у шкляной колбе. У якім выпадку газ як тэрмадынамічная сістэма з’яўляецца ізаляваным?
* Высновы тэрмадынамікі грунтуюцца на фундаментальных законах, якія носяць назву пачаткаў тэрмадынамікі. Гэтыя законы ўстаноўлены ў выніку абагульнення шматлікіх эксперыментальных фактаў. Абапіраючыся на іх, тэрмадынаміка дазваляе рабіць пэўныя высновы аб уласцівасцях даследаваных сістэм, якія пацвярджаюцца эксперыментальна. ↑
![]()
Унутраная энергія. Разглядаючы поўную энергію макраскапічнага цела, неабходна ўлічваць не толькі яго механічную энергію (кінетычную і патэнцыяльную), але таксама і энергію, якая знаходзіцца ўнутры самога цела, — унутраную энергію. У тэрмадынаміцы пад унутранай энергіяй разумеюць поўную энергію, якая мае адносіны да часціц, што ўтвараюць цела. Гэта кінетычная энергія цеплавога руху ўсіх мікрачасціц цела (малекул, атамаў, іонаў і інш.), патэнцыяльная энергія ўзаемадзеянняў гэтых мікрачасціц, энергія электронных абалонак атамаў і ўнутрыядзерная энергія. Напрыклад, пры не вельмі высокіх тэмпературах унутраную энергію ідэальнага газу можна лічыць роўнай суме кінетычных энергій хаатычнага руху яго малекул, а ўнутраную энергію іншых макраскапічных цел — алгебраічнай суме кінетычнай энергіі цеплавога руху ўсіх часціц, якія ўтвараюць цела, і патэнцыяльнай энергіі іх ўзаемадзеяння.
Унутраная энергія любой тэрмадынамічнай сістэмы складаецца з унутраных энергій цел, што ўваходзяць у дадзеную сістэму, і з’яўляецца адной з асноўных фізічных велічынь, якія выкарыстоўваюцца ў тэрмадынаміцы.
Тэрмадынаміку цікавіць не само значэнне ўнутранай энергіі сістэмы, а яе змяненне. Таму звычайна прымаюць пад увагу толькі тыя складнікі ўнутранай энергіі, якія змяняюцца ў разгляданых працэсах.
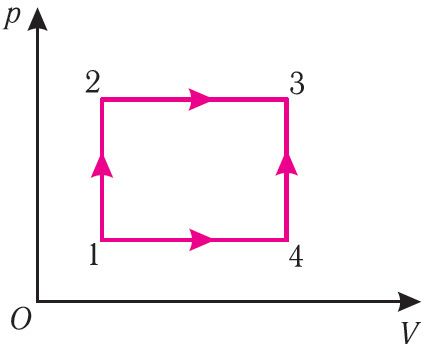
Разгледзім пераход некаторай масы ідэальнага газу са стану 1, у якім яго ўнутраная энергія U1, у стан 3, у якім яго ўнутраная энергія U3 (мал. 62). Змяненне станаў можна ажыццявіць або пры ізахорным награванні, а затым ізабарным расшырэнні (працэс 1 → 2 → 3), або пры ізабарным расшырэнні, а затым ізахорным награванні (працэс 1 → 4 → 3). Аднак прырашчэнне* ўнутранай энергіі газу ў абодвух выпадках аднолькавае:
ΔU123 = ΔU143 = U3 – U1.
Унутраная энергія залежыць ад канкрэтнага стану сістэмы. Гэта азначае, што змяненне ўнутранай энергіі пры пераходзе тэрмадынамічнай сістэмы з аднаго стану ў другі залежыць толькі ад значэнняў параметраў гэтых станаў і не залежыць ад працэсу пераходу.
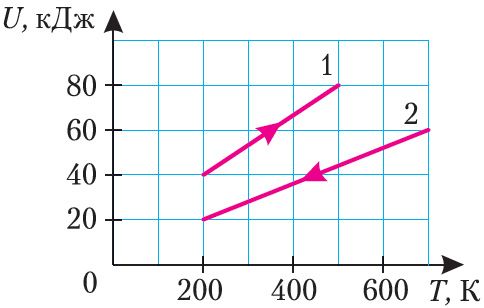
На малюнку 63 прыведзены графікі 1 і 2 залежнасці ўнутранай энергіі двух ідэальных газаў пэўнай масы ад абсалютнай тэмпературы. Ці аднолькавыя прырашчэнні ўнутранай энергіі газаў?
* Δ — прырашчэнне фізічнай велічыні, гэта значыць рознасць паміж яе канчатковым і пачатковым значэннямі;
–Δ — змяншэнне велічыні, гэта значыць рознасць паміж яе пачатковым і канчатковым значэннямі. ↑
Унутраная энергія ідэальнага аднаатамнага газу. Вызначым унутраную энергію ідэальнага аднаатамнага газу, гэта значыць газу, які складаецца з асобных атамаў. Напрыклад, аднаатамнымі з’яўляюцца інертныя газы — гелій, неон, аргон і інш.
З азначэння паняцця «ідэальны газ» вынікае, што яго ўнутраная энергія з’яўляецца сумай кінетычных энергій хаатычнага руху ўсіх атамаў або малекул (патэнцыяльная энергія ўзаемадзеяння паміж часціцамі адсутнічае). Такім чынам, унутраная энергія ідэальнага аднаатамнага газу роўная здабытку сярэдняй кінетычнай энергіі цеплавога руху часціц і іх колькасці N, гэта значыць
. Паколькі
,
дзе m — маса газу, , то
.
З улікам таго, што здабытак пастаяннай Больцмана і пастаяннай Авагадра kNA = R, дзе R — універсальная газавая пастаянная, атрымаем:
,
(11.1)
або
.
З формулы (11.1) вынікае, што ўнутраная энергія дадзенай масы ідэальнага аднаатамнага газу прапарцыянальная яго абсалютнай тэмпературы. Яна не залежыць ад іншых макраскапічных параметраў стану — ціску і аб’ёму. Такім чынам, змяненне ўнутранай энергіі дадзенай масы аднаатамнага ідэальнага газу адбываецца толькі пры змене яго тэмпературы:
.
1. Паветра пры пакаёвай тэмпературы і нармальным атмасфэрным ціску можна апісаць мадэллю ідэальнага газу. Як паказваюць разлікі, унутраная энергія двухатамнага газу большая за ўнутраную энергію аднолькавай колькасці аднаатамнага газу, які знаходзіцца пры такой жа тэмпературы, у раза. Улічыўшы, што паветра складаецца ў асноўным з двухатамных малекул, ацаніце ўнутраную энергію паветра ў пакоі, даўжыня якога а = 3,0 м, шырыня b = 3,2 м, вышыня с = 2,5 м.
Параўнайце атрыманы вынік з кінетычнай энергіяй грузавога аўтамабіля масай m = 10 т, што рухаецца са скорасцю, модуль якой . Зрабіце выснову.
2. Ідэальны аднаатамны газ, колькасць рэчыва якога ν = 10,0 моль, перавялі са стану 1 у стан 2 (мал. 64). Як і на колькі змянілася ўнутраная энергія газу?
Пры вызначэнні ўнутранай энергіі рэальных газаў, вадкасцей і цвёрдых цел неабходна ўлічваць патэнцыяльную энергію ўзаемадзеяння часціц, якая залежыць ад адлегласці паміж імі. Таму ў агульным выпадку ўнутраная энергія макраскапічных цел залежыць не толькі ад абсалютнай тэмпературы, але і ад аб’ёму.
Змяніць унутраную энергію тэрмадынамічнай сістэмы можна двума спосабамі: выкарыстоўваючы цеплаабмен і выконваючы работу. Працэс цеплаабмену і выкананне работы характарызуюць адпаведна фізічнымі велічынямі — колькасцю цеплаты Q і работай А, якія з’яўляюцца мерамі змены ўнутранай энергіі сістэмы.

1. Што называюць тэрмадынамічнай сістэмай?
2. Што разумеюць пад унутранай энергіяй макраскапічнага цела? тэрмадынамічнай сістэмы?
3. Што ўяўляе з сябе ўнутраная энергія ідэальнага газу? Ад чаго залежыць яе значэнне?

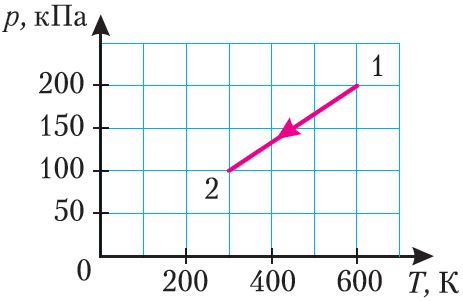
4. Iдэальны газ пераводзяць са стану 1 у стан 3 двума рознымі спосабамі: ізатэрмічна (1 → 3) і ажыццяўляючы спачатку ізабарнае расшырэнне, а затым ізахорнае ахаладжэнне (1 → 2 → 3) (мал. 65). Ці залежыць прырашчэнне ўнутранай энергіі газу ад спосабу яго пераходу са стану 1 у стан 3?
5. Ад якіх параметраў залежаць значэнні ўнутранай энергіі ідэальнага газу і ўнутранай энергіі рэальных газаў?
Прыклад 1. Пры ізабарным ахаладжэнні ўнутраная энергія ідэальнага аднаатамнага газу змянілася на ΔU = –6,0 · 102 Дж. Вызначце ціск газу, калі яго аб’ём змяніўся на ΔV = –1,0 · 102 см3.
ΔU = –6,0 · 102 Дж
ΔV = –1,0 · 102 см3 = –1,0 · 10–4 м3
Рашэнне. Прырашчэнне ўнутранай энергіі некаторай колькасці ідэальнага аднаатамнага газу
.
(1)
Выкарыстоўваючы ўраўненне Клапейрона — Мендзялеева, можна ажыццявіць замену:
.
(2)
Рашаючы сумесна ўраўненні (1) і (2), атрымаем: .
.
Адказ: .
![]()
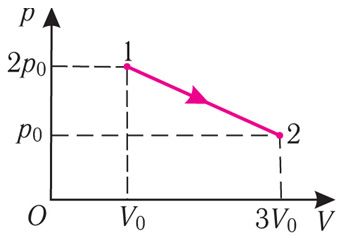
Прыклад 2. На малюнку 65.1 у каардынатах (p, V) паказаны працэс пераходу пэўнай масы ідэальнага аднаатамнага газу са стану 1 у стан 2. Вызначце змяненне ўнутранай энергіі газу, калі яго ціск у канчатковым стане p0 = 1,5 МПа, а аб’ём у пачатковым стане V0 = 2,0 л.
p0 = 1,5 МПа = 1,5 · 106 Па
V0 = 2,0 л = 2,0 · 10–3 м3
Рашэнне. Прырашчэнне ўнутранай энергіі ідэальнага аднаатамнага газу . Выкарыстоўваючы ўраўненне Клапейрона — Мендзялеева для станаў 1 i 2, можна вызначыць значэнне выразу
. Аналізуючы малюнак 65.1, можна зрабіць выснову, што ў стане 1 ціск газу 2p0, а яго аб’ём V0, а ў стане 2 — p0 i 3V0. Тады ўраўненне Клапейрона–Мендзялеева для станаў газу 1 і 2 прыме выгляд:
,
.
Аднімем ад ураўнення (2) ураўненне (1): і атрымаем, што
. Тады
.
Адказ: ΔU = 4,5 кДж.
Практыкаванне 7
1. Вызначце ўнутраную энергію аргону масай m = 4,0 г пры тэмпературы t = 27 °С.
2. Вызначце прырашчэнне ўнутранай энергіі ідэальнага аднаатамнага газу, колькасць рэчыва якога ν = 2,0 моль, пры яго награванні на Δt = 20 °С.
3. Ідэальны аднаатамны газ займае аб’ём V = 4,0 л, яго ціск p = 0,30 МПа. Вызначце ўнутраную энергію газу.
4. Пры змене стану ідэальнага аднаатамнага газу яго аб’ём павялічыўся ў α = 2,4 раза, а ціск зменшыўся ў β = 1,2 раза. Вызначце адносіны значэнняў унутранай энергіі газу ў канчатковым і пачатковым станах.
5. Маса гелію m = 2,0 кг, яго ціск p = 60 кПа. Вызначце ўнутраную энергію гелію, калі яго шчыльнасць .
6. Пры тэмпературы t = 27 °С унутраная энергія аднаатамнага ідэальнага газу U = 1,2 Дж. Вызначце колькасць атамаў газу.
![]()
7. Ідэальны аднаатамны газ пераходзіць з аднаго стану ў другі так, што яго ціск змяняецца па законе p = AT2, дзе А — каэфіцыент прапарцыянальнасці. Пры павелічэнні аб’ёму газу ў 3 разы прырашчэнне яго ўнутранай энергіі ΔU = U2 – U1 = –0,6 кДж. Вызначце першапачатковы ціск газу, калі яго аб’ём у пачатковым стане V1 = 3 л.