§ 35. Электрический ток в электролитах
При изучении предыдущего параграфа вы узнали, что в металлах перенос заряда не сопровождается переносом вещества, а носителями свободных зарядов являются электроны. Но существует класс проводников, прохождение электрического тока в которых всегда сопровождается химическими изменениями и переносом вещества. Какова природа электрического тока в таких проводниках?
Природа электрического тока в электролитах. Из опытов следует, что растворы многих солей, кислот и щелочей, а также расплавы солей и оксидов металлов проводят электрический ток, т. е. являются проводниками. Такие проводники назвали электролитами.
Электролиты — вещества, растворы или расплавы которых проводят электрический ток.
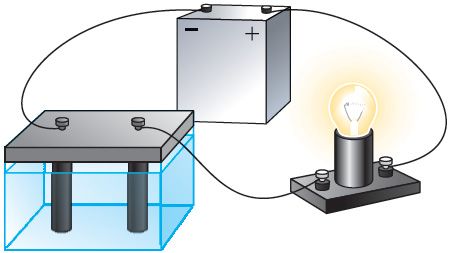
Проведём опыт. Соберём электрическую цепь, состоящую из источника тока, лампы накаливания и ванны с дистиллированной водой, в которой находятся два угольных электрода. При замыкании цепи лампа не светится, следовательно, дистиллированная вода не проводит электрический ток. Повторим опыт, добавив в дистиллированную воду сахар. Лампа не светится и в этом случае. Раствор сахара в воде также не является проводником. А теперь добавим в дистиллированную воду небольшое количество соли, например, хлорида меди(II) CuCl2. В цепи проходит электрический ток, о чём наглядно свидетельствует свечение лампы (рис. 200). Следовательно, раствор соли в воде является проводником электрического тока, т. е. при растворении хлорида меди(II) в дистиллированной воде появились свободные носители электрического заряда.
Изучая химию, вы узнали, что при растворении солей, кислот и щелочей в воде происходит электролитическая диссоциация, т. е. распад молекул электролита на ионы. В проведённом опыте хлорид меди(II) CuCl2 в водном растворе диссоциирует на положительно заряженные ионы меди Cu2+ и отрицательно заряженные ионы хлора Cl−.
![]()
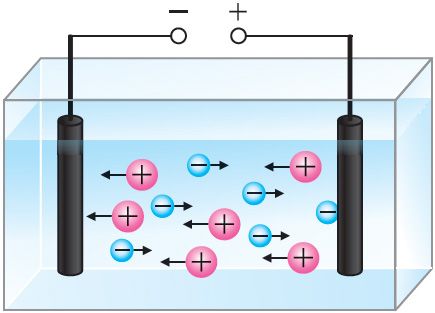
Ионы Cu2+ и Cl− в растворе при отсутствии электрического поля движутся беспорядочно. Под действием внешнего электрического поля на беспорядочное движение ионов накладывается их направленное движение (рис. 201). При этом положительно заряженные ионы Cu2+ движутся к катоду (электроду, подключённому к отрицательному полюсу источника тока), отрицательно заряженные ионы Cl− — к аноду (электроду, подключённому к положительному полюсу источника тока). На аноде будет происходить процесс окисления ионов Cl− до атомов.
Нейтральные атомы образуют молекулы хлора, который выделяется на аноде:
На катоде будет происходить процесс восстановления ионов Cu2+ до нейтральных атомов и осаждение металлической меди:
Это явление называют электролизом.
Электролиз — процесс выделения на электроде вещества, связанный с окислительно-восстановительными реакциями, протекающими при прохождении электрического тока через растворы (расплавы) электролитов.
Таким образом, свободные носители электрического заряда в электролитах — положительно и отрицательно заряженные ионы, которые образуются в результате электролитической диссоциации, а проводимость электролитов является ионной. Электролиты относят к проводникам второго рода.
Почему опасно прикасаться голыми руками к неизолированным металлическим проводам, по которым проходит электрический ток?
![]()
