§ 11. Термодинамическая система. Внутренняя энергия. Внутренняя энергия идеального одноатомного газа
![]()
Внутренняя энергия. Рассматривая полную энергию макроскопического тела, необходимо учитывать не только его механическую энергию (кинетическую и потенциальную), но также и энергию, заключённую внутри самого тела, — внутреннюю энергию. В термодинамике под внутренней энергией понимают полную энергию, относящуюся к частицам, образующим тело. Это кинетическая энергия теплового движения всех микрочастиц тела (молекул, атомов, ионов и др.), потенциальная энергия взаимодействий этих микрочастиц, энергия электронных оболочек атомов и внутриядерная энергия. Например, при не слишком высоких температурах внутреннюю энергию идеального газа можно полагать равной сумме кинетических энергий хаотического движения его молекул, а внутреннюю энергию других макроскопических тел — алгебраической сумме кинетической энергии теплового движения всех частиц, образующих тело, и потенциальной энергии их взаимодействия.
Внутренняя энергия любой термодинамической системы состоит из внутренних энергий тел, входящих в данную систему, и является одной из основных физических величин, используемых в термодинамике.
В термодинамике представляет интерес не само значение внутренней энергии системы, а её изменение. Поэтому обычно принимают во внимание только те составляющие внутренней энергии, которые изменяются в рассматриваемых процессах.
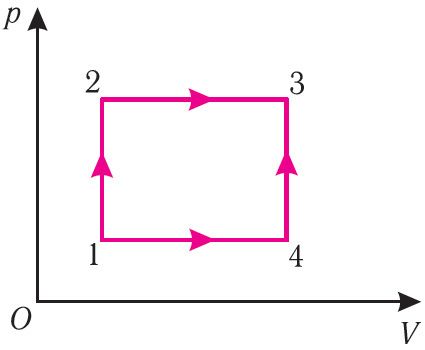
Рассмотрим переход некоторой массы идеального газа из состояния 1, в котором его внутренняя энергия U1, в состояние 3, в котором его внутренняя энергия U3 (рис. 62). Смену состояний можно осуществить или при изохорном нагревании, а затем при изобарном расширении (процесс 1 2
3), или при изобарном расширении, а затем при изохорном нагревании (процесс 1
4
3). Однако приращение* внутренней энергии газа в обоих случаях одинаково:
ΔU123 = ΔU143 = U3 – U1.
Внутренняя энергия зависит от конкретного состояния системы. Это означает, что изменение внутренней энергии при переходе термодинамической системы из одного состояния в другое зависит только от значений параметров этих состояний и не зависит от процесса перехода.
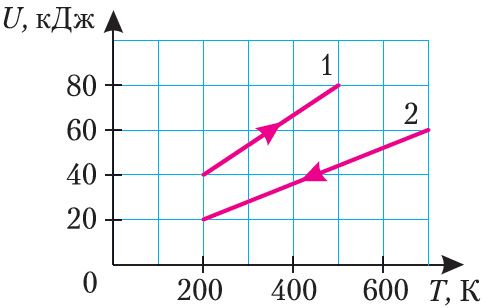
На рисунке 63 представлены графики 1 и 2 зависимости внутренней энергии двух идеальных газов определённой массы от абсолютной температуры. Одинаковы ли приращения внутренней энергии газов?
* Δ — приращение физической величины, т. е. разность между её конечным и начальным значениями;
–Δ — убыль величины, т. е. разность между её начальным и конечным значениями. ↑