§ 2. Масса и размеры молекул. Количество вещества
| Сайт: | Профильное обучение |
| Курс: | Физика. 10 класс |
| Книга: | § 2. Масса и размеры молекул. Количество вещества |
| Напечатано:: | Гость |
| Дата: | Среда, 15 Январь 2025, 19:08 |
В 1,0 см3 любого газа, находящегося при нормальных условиях (температура t0 = 0,0 °С, давление р0 = 1,0 · 105 Па), содержится 2,7 · 1019 молекул. Чтобы представить, насколько велико это число, предположим, что из отверстия в ампуле вместимостью V = 1,0 см3 ежесекундно вылетает 100 молекул. Тогда, для того чтобы все молекулы вылетели из ампулы, потребуется 8,6 млрд лет, т. е. промежуток времени, сравнимый с возрастом Вселенной (12–15 млрд лет). Такое огромное число молекул в веществе свидетельствует о том, что их размеры очень малы. Каковы же размеры и масса частиц вещества? Как определить число атомов в любом макроскопическом теле?
Молекулярно-кинетическая теория предоставляет возможность оценить массу и размеры частиц, образующих макроскопические тела. Молекулы, как и атомы, не имеют чётких границ. Если представить молекулу в виде шарика, то её радиус имеет значение от 0,1 нм у простейших до 100 нм у сложных молекул, состоящих из нескольких тысяч атомов. Например, оценочный диаметр молекулы водорода составляет 0,2 нм, а диаметр молекулы воды — 0,3 нм. При таких размерах число частиц в веществе очень велико. Например, в одном грамме воды содержится 3,3 · 1022 молекул.
Размеры и масса молекулы возрастают с увеличением числа атомов, которые входят в её состав. Атомы и молекулы (кроме многоатомных молекул органических веществ) имеют массу порядка 10–26 кг. Из-за малых значений выражать массы атомов и молекул в килограммах (кг) неудобно. Поэтому для измерения масс атомов и молекул в химии и физике используют атомную единицу массы (а. е. м.). Атомную единицу массы выражают через массу изотопа углерода :
Массу молекулы (или атома), выраженную в атомных единицах массы, называют относительной молекулярной массой Mr (или относительной атомной массой Ar). Относительная молекулярная (или атомная) масса Mr показывает, во сколько раз масса m0 молекулы (или атома) больше атомной единицы массы:
В периодической системе химических элементов Д. И. Менделеева (см. форзац 2) возле символов элементов указаны и их относительные атомные массы. В большинстве случаев при проведении расчётов значение относительной атомной массы округляют до целого числа, используя правила приближённых вычислений. Так, например, относительная атомная масса водорода равна 1, кислорода — 16, азота — 14.
Количество вещества, содержащегося в макроскопическом теле, определяют числом частиц в нём. Приведённые выше примеры показывают, насколько велико это число. Поэтому при расчётах принято использовать не абсолютное число частиц вещества, а относительное:
т. е. количество вещества ν определяют отношением числа частиц N этого вещества к постоянной Авогадро NA.
Основной единицей количества вещества в СИ является 1 моль (моль). 1 моль равен количеству вещества, содержащему столько же частиц, сколько атомов содержится в 0,012 кг изотопа углерода . Значит, в одном моле любого вещества находится одинаковое число атомов или молекул. Это число частиц обозначили NA и назвали постоянной Авогадро в честь итальянского учёного Амедео Авогадро (1776 – 1856). Постоянная Авогадро является одной из фундаментальных физических постоянных, её значение
В молекулярно-кинетической теории наряду с относительной молекулярной (или атомной) массой используют молярную массу M — массу вещества, взятого в количестве ν = 1 моль. Молярную массу M определяют отношением массы m вещества к его количеству ν:
Основной единицей молярной массы в СИ является килограмм на моль . Молярная масса вещества связана с его относительной молекулярной массой следующим соотношением:
Молярную массу вещества также можно вычислить по формуле
С учётом того, что , получим формулу для расчёта числа молекул в данном веществе:
1. Во сколько раз число молекул водорода, взятого в количестве νв = 8 моль, больше числа молекул азота, количество вещества которого νа = 4 моль?
2. Используя выражение , рассчитайте число молекул в одном грамме воды и убедитесь в справедливости приведённого в начале параграфа значения.
| Формула | Физические величины, входящие в формулу | Единицы физических величин |
| ν — количество вещества N — число частиц вещества NA — постоянная Авогадро |
моль — моль–1 |
|
| М — молярная масса | ||
| m — масса вещества m0 — масса молекулы вещества |
кг кг |
|
| NA = 6,022·1023 моль–1 |
1. В каких единицах измеряют массы атомов и молекул?
2. Что такое количество вещества? Назовите единицу этой физической величины.
3. Что такое постоянная Авогадро?
4. Что называют молярной массой вещества?
5. Объясните, почему количество вещества ν, его масса m и молярная масса М связаны соотношением .
![]()
6. Докажите, что молярную массу М можно связать с относительной молекулярной (атомной) массой Мr вещества соотношением .
7. Докажите, что концентрацию частиц вещества можно определить по формуле , где m0 — масса одной молекулы, ρ — плотность вещества.
1. Предложите способ определения примерного числа молекул, испарившихся с каждого квадратного сантиметра поверхности воды, налитой в стакан, за промежуток времени Δt = 1 с.
Оборудование: стакан с водой, электронные весы (как можно с большей точностью измерения), секундомер, линейка.
2. Предложите способ определения числа частиц в кусочке мела (СаСО3).
Оборудование: кусочек мела, электронные весы.
Пример 1. Определите молярную массу и массу одной молекулы сульфата меди(II) CuSO4.
Решение. Чтобы вычислить молярную массу М любого вещества, необходимо по химической формуле найти относительную молекулярную массу Mr этого вещества и полученное значение умножить на . Поскольку химическая формула сульфата меди(II) имеет вид CuSO4, то
Тогда молярная масса
Для определения массы молекулы CuSO4 воспользуемся формулой *:
Ответ:
Пример 2. Определите количество вещества и число атомов, содержащихся в железном бруске объёмом V = 100 см3. Плотность железа .
N — ?
Решение: Количество вещества можно определить, воспользовавшись формулой , где m — масса железного бруска, а
— молярная масса железа. Поскольку
, то
.
Число атомов в данном железном бруске .
Ответ: ν = 14 моль, N = 8,4 · 1024.
* При решении задач постоянную Авогадро принять равной NA = 6,02 · 1023 моль–1 ↑
Упражнение 1
1. Определите молярные массы и массы молекул: а) воды H2O; б) углекислого газа CO2; в) аммиака NH3; г) азотной кислоты HNO3.
2. В стакан налита вода H2O массой m = 0,20 кг. Определите количество вещества и число молекул воды в стакане.
3. Определите массу молекул сероводорода H2S.
4. Сравните число частиц вещества в алюминиевом и медном кубиках одинакового объёма. Плотность алюминия , плотность меди
5. В серебряной пластинке атомов. Определите объём пластинки, если плотность серебра
.
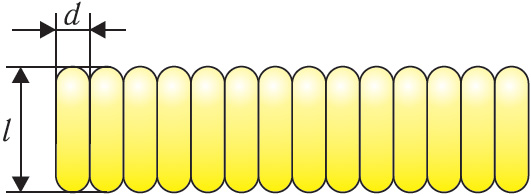
6. Английский физик Джон Уильям Стретт, лорд Рэлей (1842–1919), предложил такой способ оценки размеров молекул: на поверхность воды в широком сосуде он капнул каплю оливкового масла объёмом и плотностью
. Капля растеклась, образовав плёнку площадью
. Определите по этим данным массу и диаметр молекулы оливкового масла, приняв толщину плёнки равной длине цилиндрических по форме молекул масла (рис. 13). Молярную массу оливкового масла примите
.
![]()
7. Вода в открытом сосуде испарилась за промежуток времени Δt = 6,0 суток. Определите массу воды, находившейся в сосуде, если с её поверхности ежесекундно вылетало в среднем молекул.
8. Масса газа, молекулы которого состоят из атомов водорода и углерода, . Определите массы всех атомов водорода и углерода, если число молекул газа
.
9. Капелька духов, содержавшая ароматическое вещество массой , испарилась в комнате вместимостью
. Молярная масса ароматического вещества
. Определите среднее число
молекул этого вещества, попадающих при каждом вдохе в лёгкие человека, если объём вдыхаемого воздуха
.