ЗАКЛЮЧЭННЕ. АДКАЗЫ
| Сайт: | Профильное обучение |
| Курс: | Хімія. 10 клас |
| Книга: | ЗАКЛЮЧЭННЕ. АДКАЗЫ |
| Напечатано:: | Гость |
| Дата: | Четверг, 3 Июль 2025, 07:49 |
Заключэнне
Мы завяршылі вывучэнне курса арганічнай хіміі. Падвядзём кароткі вынік. Арганічная хімія — хімія злучэнняў вугляроду. Дзякуючы ўнікальнай будове атама, у якім валентны ўзровень запоўнены роўна напалавіну, атамы вугляроду лёгка злучаюцца паміж сабой дастаткова трывалымі кавалентнымі сувязямі з утварэннем лінейных, разгалінаваных ланцугоў і цыклаў. Гэтыя структуры могуць змяшчаць толькі адзінарныя сувязі, а таксама ўключаць кратныя (двайныя і трайныя) сувязі. Асаблівы выпадак уяўляюць сабой араматычныя злучэнні, што змяшчаюць цыклы з адзінарнымі і двайнымі сувязямі, якія чаргуюцца (спалучанымі сувязямі). Калі вугляродны шкілет дапаўняецца атамамі вадароду, мы маем справу з вуглевадародамі, якіх невычэрпнае мноства.
Нягледзячы на велізарную разнастайнасць структур вуглевадародаў, уласцівасці іх даволі нешматлікія. Вуглевадароды гараць, гэтым абумоўлена іх практычнае прымяненне ў якасці энерганосьбітаў. Найбольш устойлівыя вуглевадароды — алканы і арэны — уступаюць у рэакцыі замяшчэння, у выніку якіх вугляродны шкілет захоўваецца, а атамы вадароду могуць быць замешчаны на іншыя атамы, у прыватнасці на атамы галагенаў. Малекулы алканаў пры высокіх тэмпературах і цісках могуць быць расшчэплены на малекулы вуглевадародаў з меншымі малекулярнымі масамі. Гэтыя працэсы шырока выкарыстоўваюцца пры перапрацоўцы прыроднай вуглевадароднай сыравіны.
У адрозненне ад алканаў і арэнаў, вуглевадароды, малекулы якіх змяшчаюць двайныя і трайныя сувязі (алкены, алкадыены і алкіны) лёгка ўступаюць у рэакцыі далучэння, якія прыводзяць да атрымання алканаў (гідрыраванне), галагенвытворных (галагенаванне, гідрагалагенаванне), спіртоў (гідратацыя), палімераў (полімерызацыя). Араматычныя вуглевадароды таксама ўступаюць у рэакцыі далучэння, утвараючы цыклаалканы.
Гэтымі ўласцівасцямі на дадзеным этапе вывучэння арганічнай хіміі абмяжоўваецца хімія вуглевадародаў. Значна больш разнастайныя хімічныя ўласцівасці арганічных злучэнняў, малекулы якіх уключаюць, акрамя атамаў вугляроду і вадароду, атамы іншых элементаў. Атамы кіслароду ў саставе арганічных злучэнняў з’яўляюцца састаўной часткай функцыянальных груп: гідраксільнай ![]() ОН, альдэгіднай
ОН, альдэгіднай ![]() СНО, карбаксільнай
СНО, карбаксільнай ![]() СООН. Спірты і фенолы, малекулы якіх змяшчаюць гідраксільныя групы, праяўляюць слабыя кіслотныя ўласцівасці, што дазваляе ім узаемадзейнічаць са шчолачнымі металамі (спірты) і нават шчолачамі (фенолы).
СООН. Спірты і фенолы, малекулы якіх змяшчаюць гідраксільныя групы, праяўляюць слабыя кіслотныя ўласцівасці, што дазваляе ім узаемадзейнічаць са шчолачнымі металамі (спірты) і нават шчолачамі (фенолы).
Самымі сапраўднымі кіслотамі з’яўляюцца карбонавыя кіслоты, малекулы якіх змяшчаюць карбаксільныя групы. Яны змяняюць афарбоўку індыкатараў, рэагуюць са шчолачамі, актыўнымі металамі, солямі, аксідамі металаў. Кіслоты таксама ўступаюць у рэакцыю этэрыфікацыі са спіртамі з утварэннем складаных эфіраў. Прадстаўнікамі складаных эфіраў з’яўляюцца тлушчы, яны ўтвораны трохатамным спіртам гліцэрынай і вышэйшымі тлустымі кіслотамі, важнейшыя з якіх — пальміцінавая, стэарынавая, алеінавая, лінолевая і ліналенавая.
Альдэгіды, малекулы якіх змяшчаюць групу ![]() СНО, з’яўляюцца важным класам арганічных злучэнняў, але на дадзеным этапе вывучэння арганічнай хіміі мы абмежаваліся знаёмствам са здольнасцю альдэгідаў акісляцца да карбонавых кіслот (рэакцыя «сярэбранага люстра») і аднаўляцца да спіртоў. Альдэгідную групу змяшчаюць малекулы многіх вугляводаў, у прыватнасці глюкозы. Вугляводы — біфункцыянальныя арганічныя злучэнні, іх малекулы ўключаюць, нараўне з альдэгіднай, гідраксільныя групы. Глюкоза з’яўляецца пяціатамным альдэгідаспіртам і праяўляе хімічныя ўласцівасці, характэрныя для мнагаатамных спіртоў і альдэгідаў. На гэтым прыкладзе бачна, што веданне будовы малекул арганічных злучэнняў дазваляе тлумачыць і нават прадказваць іх уласцівасці, што робіць магчымым мэтанакіраваны сінтэз рэчываў.
СНО, з’яўляюцца важным класам арганічных злучэнняў, але на дадзеным этапе вывучэння арганічнай хіміі мы абмежаваліся знаёмствам са здольнасцю альдэгідаў акісляцца да карбонавых кіслот (рэакцыя «сярэбранага люстра») і аднаўляцца да спіртоў. Альдэгідную групу змяшчаюць малекулы многіх вугляводаў, у прыватнасці глюкозы. Вугляводы — біфункцыянальныя арганічныя злучэнні, іх малекулы ўключаюць, нараўне з альдэгіднай, гідраксільныя групы. Глюкоза з’яўляецца пяціатамным альдэгідаспіртам і праяўляе хімічныя ўласцівасці, характэрныя для мнагаатамных спіртоў і альдэгідаў. На гэтым прыкладзе бачна, што веданне будовы малекул арганічных злучэнняў дазваляе тлумачыць і нават прадказваць іх уласцівасці, што робіць магчымым мэтанакіраваны сінтэз рэчываў.
Малекулы найпрасцейшых вугляводаў (монацукрыдаў) лёгка падвяргаюцца ўнутрымалекулярнай цыклізацыі. Цыклы, у сваю чаргу, за кошт міжмалекулярнай дэгідратацыі ўтвараюць малекулы дыцукрыдаў (мальтоза, цукроза) і макрамалекулы поліцукрыдаў (цэлюлоза, крухмал).
Вывучаючы кіслародзмяшчальныя арганічныя злучэнні, мы ўбачылі сярод іх рэчывы, якія ўваходзяць у састаў жывых арганізмаў. Гэта карбонавыя кіслоты, тлушчы і вугляводы, якія з’яўляюцца асновай расліннага і жывёльнага свету. Пашырыла рамкі знаёмства з «хіміяй жывога» вывучэнне азотзмяшчальных арганічных злучэнняў, якое прывяло нас да бялкоў — рэчываў, з якіх пабудаваны аб’екты жывёльнага свету, у тым ліку чалавек. Мы ўбачылі, што атам азоту ў саставе амінагрупы надае рэчывам асноўныя ўласцівасці. Амінакіслоты — арганічныя амфатэрныя злучэнні, малекулы якіх змяшчаюць асноўную ![]() NH2 і кіслотную
NH2 і кіслотную ![]() СООН групы. Міжмалекулярная дэгідратацыя амінакіслот прыводзіць да пептыдаў, якімі з’яўляюцца бялкі.
СООН групы. Міжмалекулярная дэгідратацыя амінакіслот прыводзіць да пептыдаў, якімі з’яўляюцца бялкі.
Веданне асноў арганічнай хіміі дазволіла нам разабрацца з асновамі хіміі высокамалекулярных злучэнняў, якія ўтвараюцца ў выніку рэакцый полімерызацыі і полікандэнсацыі арганічных рэчываў.
Кароткі агляд вывучанага матэрыялу паказвае, што арганічная хімія займае асаблівае месца не толькі сярод хімічных, але і сярод усіх прыродазнаўчых навук. Яна дазваляе нам меркаваць аб будове і ўласцівасцях рэчываў, з якіх складаецца навакольны свет жывой прыроды, а таксама зразумець значэнне дасягненняў хімічнай навукі для задавальнення патрэб сучаснага грамадства ў рэчывах, без якіх яно проста не зможа існаваць.
Пазнаёміцца на практыцы з некаторымі сінтэтычнымі палімерамі, а таксама з пытаннямі і заданнямі павышанага ўзроўню складанасці вы можаце, перайшоўшы па спасылках у QR-кодах.
Адказы
§ 5. 7. 85,04 %.
§ 10. 3. 9 рэчываў; 4. 89,6 дм3; 5. 24 г.
§ 11. 1. С3Н8; 2. СН4; 3. С6Н14, 5 ізамераў; 4. С5Н12, 3 ізамеры; 5. C2H6O; 6. С6Н14.
§ 14. 4. Бутэн-1.
§ 15. 5. а) 5600 г/моль, б) 200; 6. 4 дм3.
§ 16. 4. А — С3Н6, Б — С3Н8; 5. 2,3-дыметылбутэн-2; 6. C5H10; 7. 235,2 кг.
§ 17. 7. 30 : 1.
§ 18. 5. Бутын-2; 6. 819 дм3.
§ 19. 6. Бензол.
§ 21. 5. Гептан і этылен; 6. 1,78 дм3; 8. в) 80, г) С6Н14, д) 60 кг.
§ 24. 1. 0,584 дм3; 6. 27,6 %; 7. 247 дм3.
§ 25. 6. 1,68 дм3.
§ 28. 4. 32,8 см3.
§ 30. 4. С4Н9СНО; 5. 4,9 кг.
§ 32. 5. 56,6 г/моль.
§ 33. 4. А — бутанол-2, В — бутэн-2, Г — бутанол-1.
§ 34. 5. 5,09 кг.
§ 35. 1. CnH2n—1 ![]() COOH.
COOH.
§ 36. 1. 1,64 г; 2. 41,1 см3; 3. 35,5 см3 раствору кіслаты або прыкладна 3,5 сталовых лыжак воцату.
§ 38. 4. 33 г; 5. 23.
§ 39. 2. Трыалеат гліцэрыны; 3. Трыалеат гліцэрыны.
§ 41. 5. 2,3 г; 6. 35,6 см3.
§ 42. 9. 1,13, менш; 10. 538 г; 11. 31,4 г.
§ 43. 6. 2500; 7. а) 185 і б) 580 кг; 8. 84 г.
§ 44. 4. 8765; 6. А — цэлюлоза, В — глюкоза, С — глюконавая кіслата.
§ 45. 4. CnH2n+3N; 7. С3Н9N.
§ 46. 7. С2Н7N; 8. а) С3Н9N, б) метылэтыламін.
§ 47. 5. 4 дыпептыды; 8. а) С5Н11О2N, б)
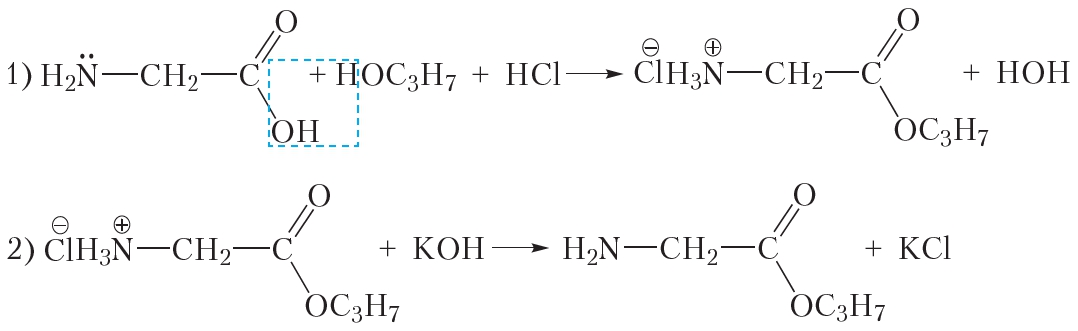
9. С7Н13О4N3.
§ 48. 5. Прыкладна 5 818 г/моль; 6. Гліцылгліцын; 7. Аланілаланін.

