§ 48. Бялкі
Бялкі
Малекулы бялкоў пабудаваны з астаткаў α-амінакіслот:
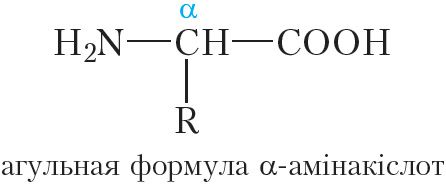
Утварэнне малекулы бялку з α-амінакіслот можна прадставіць наступнай схемай:
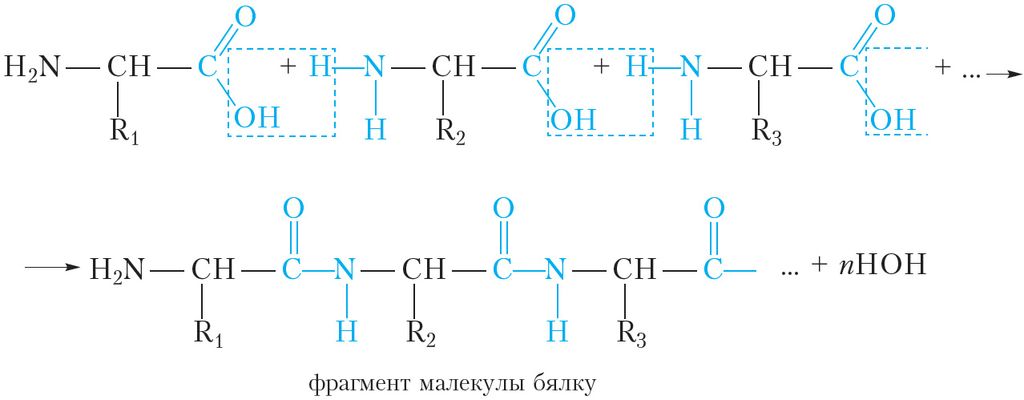
Відаць, што ў малекулах бялкоў амінакіслотныя астаткі злучаны пептыднымі сувязямі, такім чынам, бялкі з’яўляюцца поліпептыдамі.
Малекулы бялкоў звычайна змяшчаюць сотні і нават тысячы амінакіслотных астаткаў. Пры гэтым найбольш часта ў саставе бялкоў сустракаюцца астаткі 20 розных амінакіслот (табл. 48.1).
| Формула | Назва | Абазначэнне |
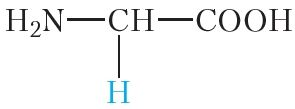 |
гліцын | глі |
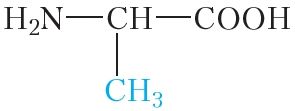 |
аланін | ала |
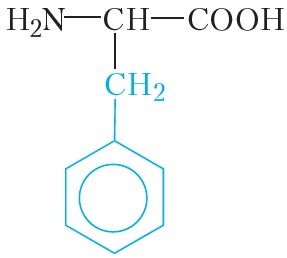 |
фенілаланін | фен |
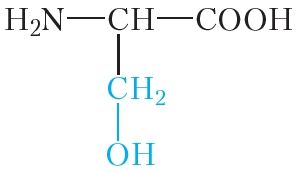 |
серын | сер |
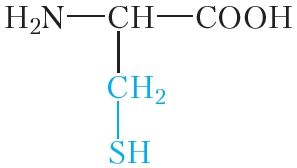 |
цыстэін | цыс |
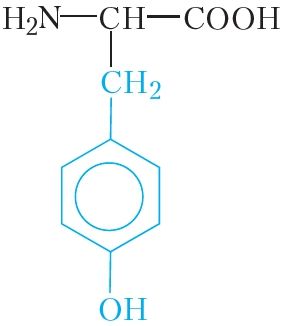 |
тыразін | тыр |
Астаткі гэтых амінакіслот размешчаны ў макрамалекулах бялку ў строга вызначанай паслядоўнасці (мал. 48.1).
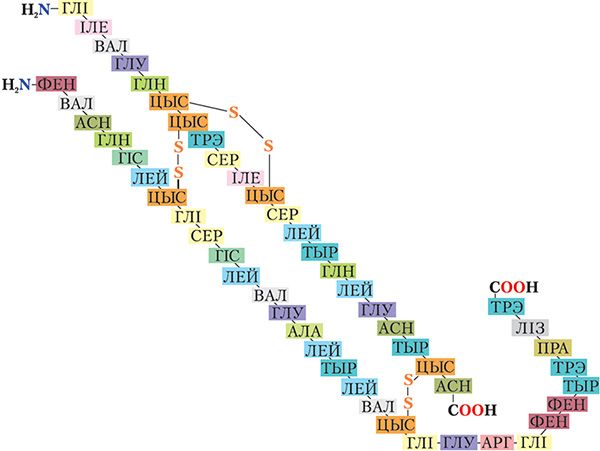
З малюнка 48.1 відаць, што малекула бялку інсуліну складаецца з двух поліпептыдных ланцугоў, злучаных двума дысульфіднымі масткамі (![]() S
S ![]() S
S ![]() ). Кожны поліпептыдны ланцуг характарызуецца строга вызначанай паслядоўнасцю амінакіслотных астаткаў, прычым астаткі многіх амінакіслот сустракаюцца ў малекуле інсуліну некалькі разоў. Напрыклад, з малюнка 48.1 відаць, што астатак гліцыну (глі) сустракаецца ў малекуле інсуліну чатыры разы.
). Кожны поліпептыдны ланцуг характарызуецца строга вызначанай паслядоўнасцю амінакіслотных астаткаў, прычым астаткі многіх амінакіслот сустракаюцца ў малекуле інсуліну некалькі разоў. Напрыклад, з малюнка 48.1 відаць, што астатак гліцыну (глі) сустракаецца ў малекуле інсуліну чатыры разы.
На першы погляд можа здацца, што выкарыстанне 20 розных амінакіслот для пабудовы малекул бялкоў істотна абмяжоўвае разнастайнасць бялковых структур. На самай справе колькасць камбінацый, якую можна скласці, выкарыстоўваючы для пабудовы поліпептыдных ланцугоў 20 розных амінакіслот, практычна бясконцая. Напрыклад, калі поліпептыдны ланцуг будзе складацца са 100 амінакіслотных астаткаў, то, выкарыстоўваючы для яго пабудовы 20 розных амінакіслот, можна скласці 20100 камбінацый!