§ 46. Хімічныя ўласцівасці, атрыманне і прымяненне амінаў
Хімічныя ўласцівасці насычаных амінаў
1. Асноўныя ўласцівасці
У малекулах амінаў у атама азоту маецца непадзеленая электронная пара, таму яны могуць далучаць катыён вадароду H+:
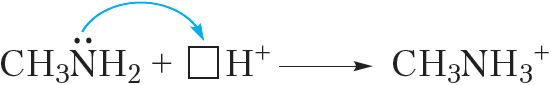
або
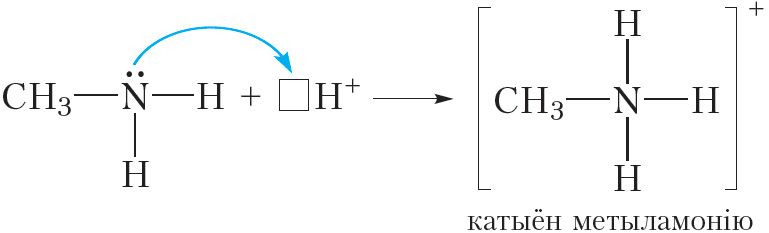
Гэта значыць, таксама як і аміяк, аміны праяўляюць асноўныя ўласцівасці. Так, пры растварэнні метыламіну ў вадзе працякае абарачальная рэакцыя:
![]()
або
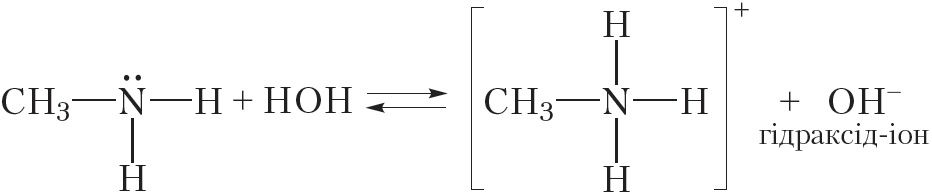
Відаць, што пры ўзаемадзеянні з вадой малекула метыламіну далучае катыён вадароду. Пры гэтым утвараюцца іон метыламонію CH3NH3+ і гідраксід-іон OH–. Наяўнасць іонаў OH– абумоўлівае шчолачную рэакцыю водных раствораў метыламіну, таму раствор метыламіну ў вадзе афарбоўвае фенолфталеін у малінавы колер.
Асноўныя ўласцівасці амінаў праяўляюцца таксама ў рэакцыях з кіслотамі. Напрыклад, пры ўзаемадзеянні метыламіну з салянай кіслатой утвараецца соль — хларыд метыламонію:
![]()
або
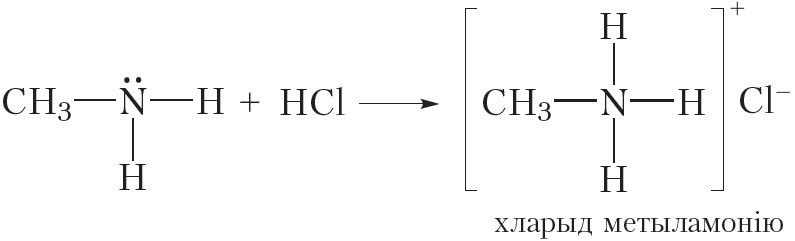
Як і ўсе солі, хларыд метыламонію мае іонную будову. Ён складаецца з катыёну метыламонію і хларыд-аніёну. Хларыд метыламонію — цвёрдае, добра растваральнае ў вадзе рэчыва.
Аналагічна працякаюць рэакцыі метыламіну і з іншымі кіслотамі:
![]()
або
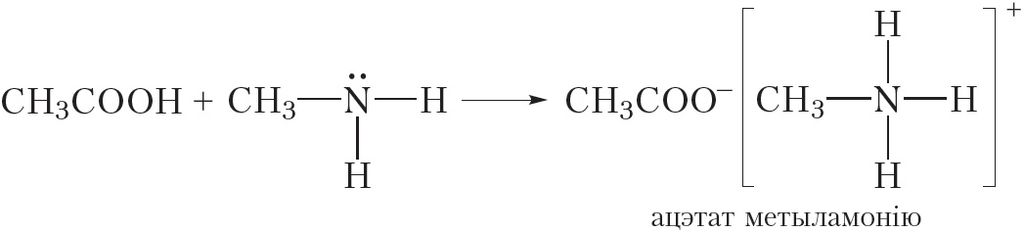
Гэтыя рэакцыі заключаюцца ў далучэнні катыёну вадароду H+ да малекулы метыламіну.
Мы разгледзілі ўзаемадзеянне метыламіну з вадой і кіслотамі. Відавочна, падобным чынам гэтыя рэакцыі будуць працякаць і для іншых амінаў:
![]()
або
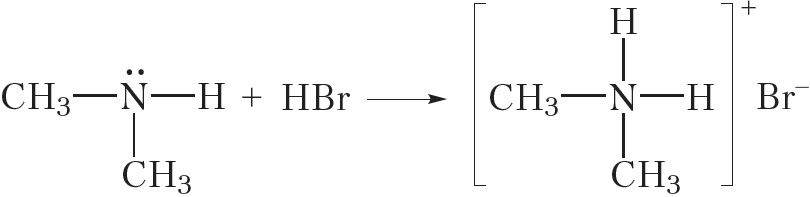
Солі амінаў — цвёрдыя, добра растваральныя ў вадзе рэчывы. Шчолачы выцясняюць аміны з солей:
![]()
Падобную рэакцыю вы сустракалі пры вывучэнні неарганічнай хіміі, калі разглядалі выцясненне аміяку з солей амонію пад дзеяннем шчолачаў.
2. Гарэнне
Як і большасць арганічных злучэнняў, аміны гараць у кіслародзе. Пры гэтым утвараюцца вуглякіслы газ, вада і азот:
![]()