§ 46. Хімічныя ўласцівасці, атрыманне і прымяненне амінаў
| Сайт: | Профильное обучение |
| Курс: | Хімія. 10 клас |
| Книга: | § 46. Хімічныя ўласцівасці, атрыманне і прымяненне амінаў |
| Напечатано:: | Гость |
| Дата: | Пятница, 4 Июль 2025, 19:02 |
Хімічныя ўласцівасці насычаных амінаў
1. Асноўныя ўласцівасці
У малекулах амінаў у атама азоту маецца непадзеленая электронная пара, таму яны могуць далучаць катыён вадароду H+:
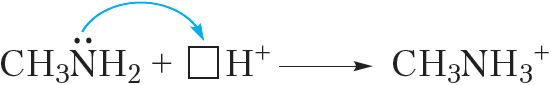
або
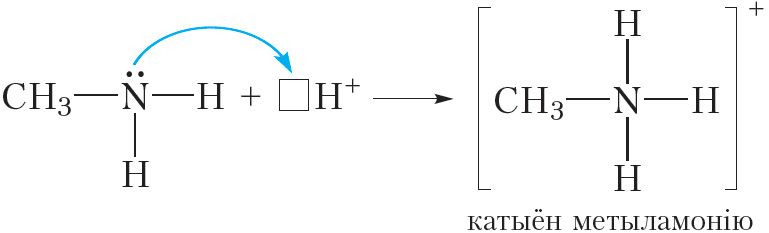
Гэта значыць, таксама як і аміяк, аміны праяўляюць асноўныя ўласцівасці. Так, пры растварэнні метыламіну ў вадзе працякае абарачальная рэакцыя:
![]()
або
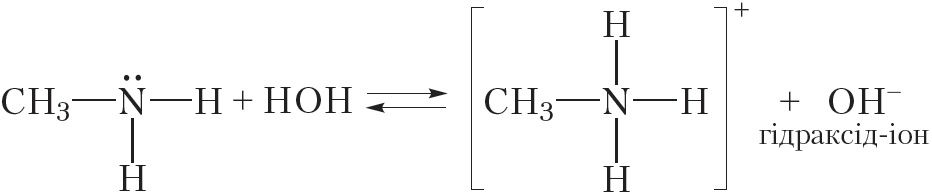
Відаць, што пры ўзаемадзеянні з вадой малекула метыламіну далучае катыён вадароду. Пры гэтым утвараюцца іон метыламонію CH3NH3+ і гідраксід-іон OH–. Наяўнасць іонаў OH– абумоўлівае шчолачную рэакцыю водных раствораў метыламіну, таму раствор метыламіну ў вадзе афарбоўвае фенолфталеін у малінавы колер.
Асноўныя ўласцівасці амінаў праяўляюцца таксама ў рэакцыях з кіслотамі. Напрыклад, пры ўзаемадзеянні метыламіну з салянай кіслатой утвараецца соль — хларыд метыламонію:
![]()
або
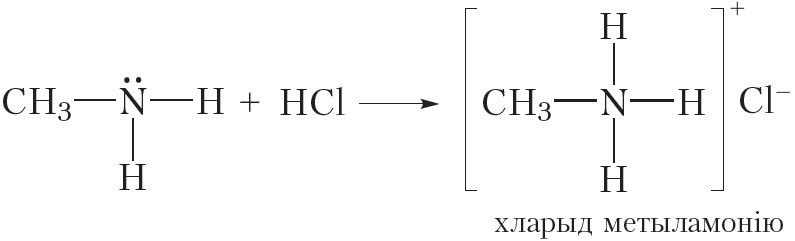
Як і ўсе солі, хларыд метыламонію мае іонную будову. Ён складаецца з катыёну метыламонію і хларыд-аніёну. Хларыд метыламонію — цвёрдае, добра растваральнае ў вадзе рэчыва.
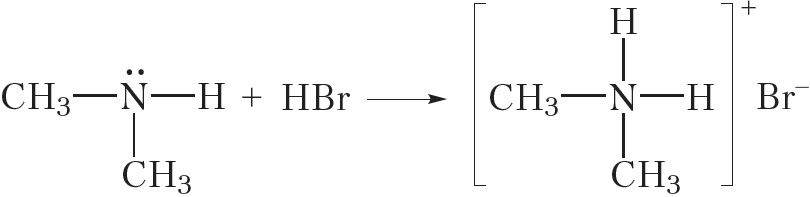
Аналагічна працякаюць рэакцыі метыламіну і з іншымі кіслотамі:
![]()
або
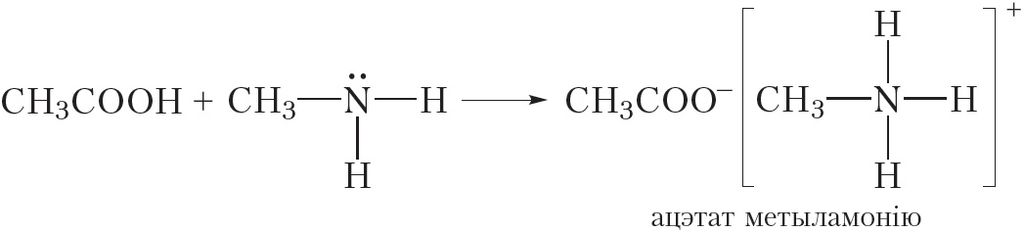
Гэтыя рэакцыі заключаюцца ў далучэнні катыёну вадароду H+ да малекулы метыламіну.
Мы разгледзілі ўзаемадзеянне метыламіну з вадой і кіслотамі. Відавочна, падобным чынам гэтыя рэакцыі будуць працякаць і для іншых амінаў:
![]()
або
Солі амінаў — цвёрдыя, добра растваральныя ў вадзе рэчывы. Шчолачы выцясняюць аміны з солей:
![]()
Падобную рэакцыю вы сустракалі пры вывучэнні неарганічнай хіміі, калі разглядалі выцясненне аміяку з солей амонію пад дзеяннем шчолачаў.
2. Гарэнне
Як і большасць арганічных злучэнняў, аміны гараць у кіслародзе. Пры гэтым утвараюцца вуглякіслы газ, вада і азот:
![]()
Хімічныя ўласцівасці аніліну
Структурная формула аніліну:
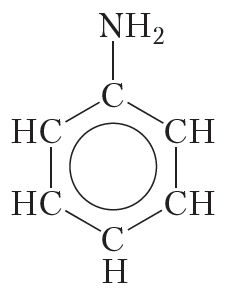
З-за ўплыву бензольнага кольца на амінагрупу некаторыя ўласцівасці аніліну адрозніваюцца ад хімічных уласцівасцей насычаных амінаў. З другога боку, амінагрупа ў малекуле аніліну аказвае ўплыў на ўласцівасці бензольнага кольца.
Рэакцыі па амінагрупе
З-за ўплыву бензольнага кольца на амінагрупу асноўныя ўласцівасці аніліну выяўлены слабей, чым у насычаных амінаў. Так, у адрозненне ад насычаных амінаў, водны раствор аніліну не змяняе афарбоўку індыкатараў. У той жа час, падобна насычаным амінам, анілін утварае солі пры ўзаемадзеянні з кіслотамі:
![]()
або
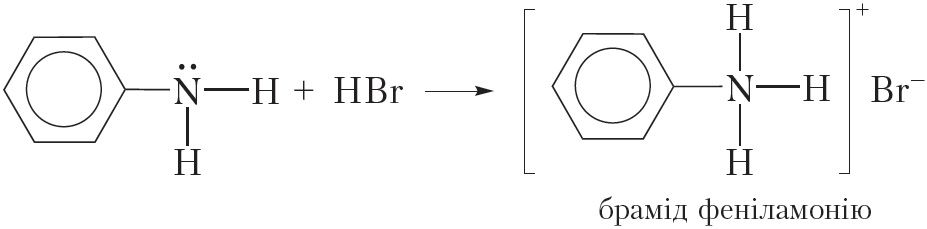
Рэакцыі замяшчэння ў бензольным кольцы
У малекуле аніліну амінагрупа ўплывае на ўласцівасці бензольнага кольца, палягчаючы замяшчэнне атамаў вадароду. Так, пры змешванні раствору аніліну з бромнай вадой назіраецца яе абясколерванне і выпадзенне белага асадку. Ураўненне рэакцыі, якая працякае:
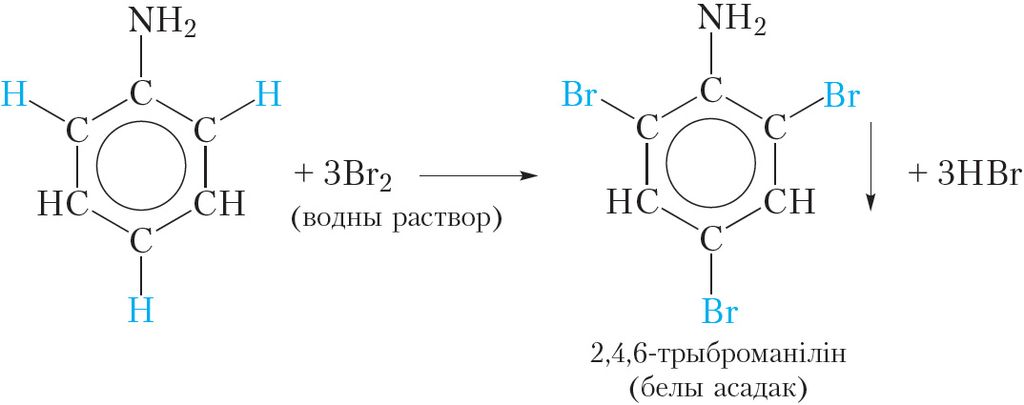
У выніку рэакцыі адбываецца замяшчэнне трох атамаў вадароду бензольнага кольца атамамі брому і ўтвараецца 2,4,6-трыброманілін. Адзначым, што замяшчэнне атама вадароду бензольнага кольца атамам брому магчыма і для бензолу, але ўмовы працякання рэакцыі значна больш жорсткія, чым для аніліну. Напомнім, што падобны ўплыў на бензольнае кольца аказвае гідраксільная група ў малекуле фенолу (§ 28).
Атрыманне амінаў
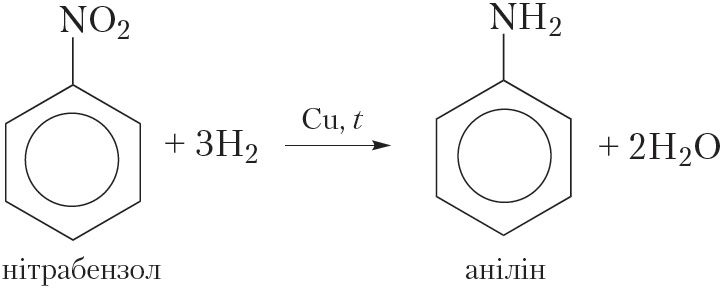
Аміны можна атрымаць з нітразлучэнняў, з якімі вы пазнаёміліся пры вывучэнні нітравання бензолу (§ 20). Сутнасць рэакцыі атрымання амінаў з нітразлучэнняў становіцца зразумелай, калі разгледзець формулы нітразлучэнняў і амінаў:
![]()
Як бачна, каб атрымаць амін з нітразлучэння, неабходна ў малекуле нітразлучэння «замяніць» атамы кіслароду на атамы вадароду, гэта значыць аднавіць рэчыва. Прывядзём схему такой рэакцыі:
![]()
Прыведзеная схема не паказвае, якое рэчыва выкарыстоўваецца для аднаўлення нітразлучэння, адноўнік тут умоўна пазначаны [H]. Разгледзім, якія рэчывы выкарыстоўваюць на практыцы для аднаўлення нітразлучэнняў.
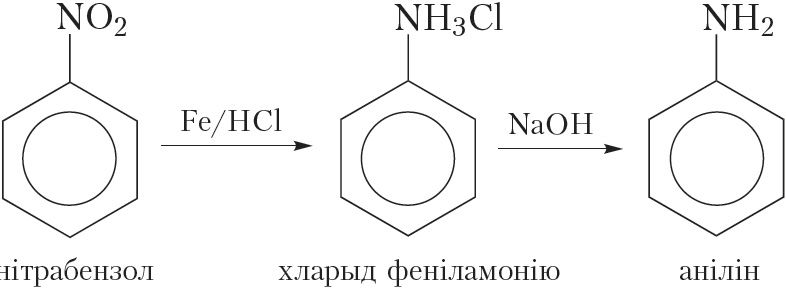
Аднаўленне нітразлучэнняў вадародам у прысутнасці каталізатара:
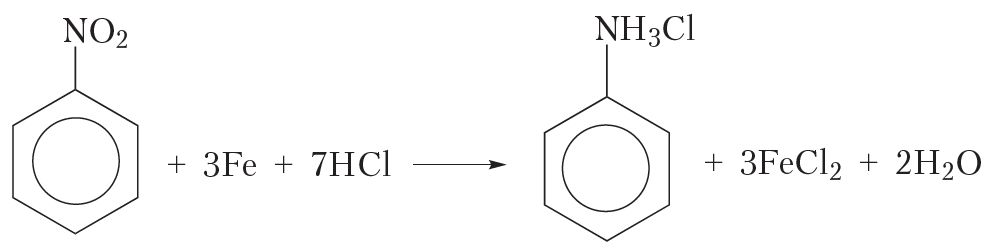
Аднаўленне нітразлучэнняў вадародам у момант вылучэння. Для атрымання аніліну такім метадам у колбу змяшчаюць нітрабензол, канцэнтраваную саляную кіслату і жалезнае пілавінне. Жалеза ўзаемадзейнічае з салянай кіслатой з утварэннем вадароду, які ў першы момант вылучаецца ў атамарным выглядзе:
![]()
Атамарны вадарод мае высокую рэакцыйную здольнасць і, не паспеўшы злучыцца ў менш актыўныя малекулы H2, аднаўляе нітрагрупу малекулы нітрабензолу:
![]()
Анілін, які атрымліваецца пры гэтым, узаемадзейнічае з салянай кіслатой, утвараючы соль:
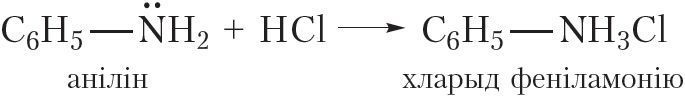
Сумарнае ўраўненне рэакцыі аднаўлення нітрабензолу вадародам у момант вылучэння:
З атрыманай солі дзеяннем шчолачы выцясняюць анілін:
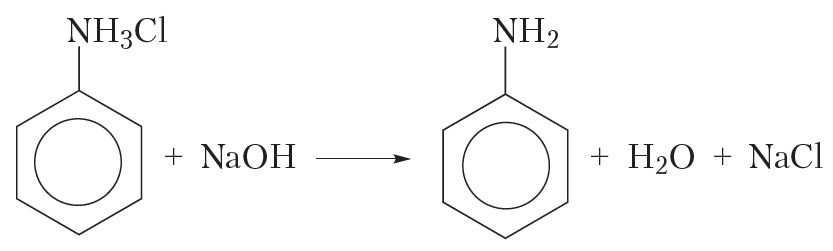
Такім чынам, працэс атрымання аніліну шляхам аднаўлення нітрабензолу вадародам у момант вылучэння можна адлюстраваць схемай:

Мікалаевіч Зінін
Цікава ведаць
Рэакцыя атрымання амінаў аднаўленнем нітразлучэнняў носіць імя вядомага рускага хіміка Мікалая Мікалаевіча Зініна (1812–1880). Ён не толькі зрабіў значны ўклад у развіццё арганічнай хіміі, але і стварыў бліскучую школу рускіх хімікаў-арганікаў. Яго вучнямі былі Аляксандр Міхайлавіч Бутлераў — заснавальнік тэорыі будовы арганічных злучэнняў — і Аляксандр Парфір’евіч Барадзін — вядомы хімік і кампазітар, аўтар оперы «Князь Ігар».
Аб іншых метадах атрымання амінаў вы можаце даведацца, перайшоўшы па спасылцы ў QR-кодзе.
Аміны шырока выкарыстоўваюцца ў арганічным сінтэзе. Яны з’яўляюцца зыходнымі рэчывамі для атрымання фарбавальнікаў, лекавых прэпаратаў і многіх іншых рэчываў.
Аміны таксама, як і аміяк, праяўляюць асноўныя ўласцівасці. Водныя растворы насычаных амінаў маюць шчолачную рэакцыю і таму змяняюць афарбоўку індыкатараў. Аміны ўтвараюць солі пры ўзаемадзеянні з кіслотамі.
Аміны гараць у кіслародзе. Пры гэтым утвараюцца вуглякіслы газ, вада і азот.
Асноўныя ўласцівасці аніліну выяўлены слабей, чым у насычаных амінаў. Водны раствор аніліну не змяняе афарбоўку індыкатараў. У той жа час анілін, як і насычаныя аміны, утварае солі пры ўзаемадзеянні з кіслотамі.
Амінагрупа малекулы аніліну ўплывае на бензольнае кольца, палягчаючы замяшчэнне атамаў вадароду ў становішчах 2, 4, 6, таму, у адрозненне ад бензолу, анілін абясколервае бромную ваду.
Аміны атрымліваюць аднаўленнем нітразлучэнняў.
*Атрыманне амінаў
1. Атрыманне амінаў узаемадзеяннем спіртоў з аміякам
У прамысловасці найпрасцейшыя аміны (метыламін, дыметыламін і інш.) атрымліваюць узаемадзеяннем спіртоў з аміякам у прысутнасці каталізатара пры тэмпературы 300–500 °С. Пры гэтым гідраксільная група спірту замяшчаецца на амінагрупу. У рэакцыі, акрамя першасных амінаў, утвараюцца таксама другасныя і трацічныя аміны:
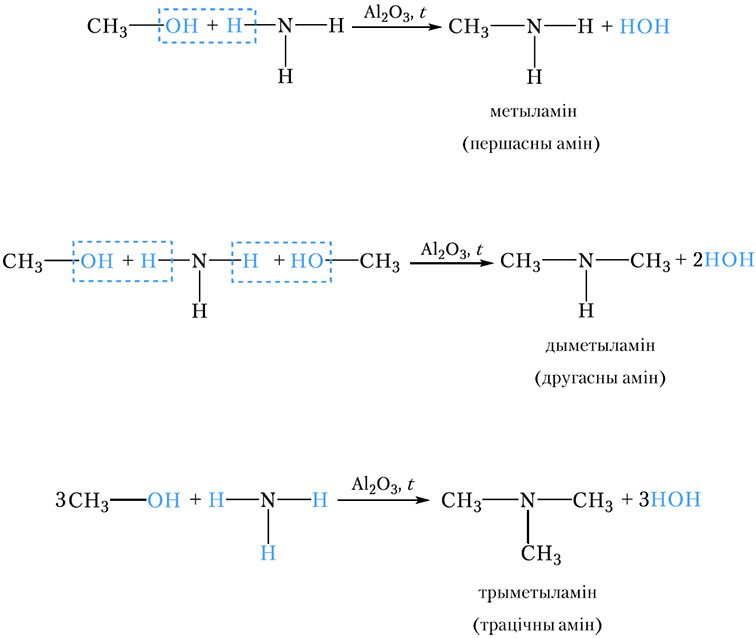
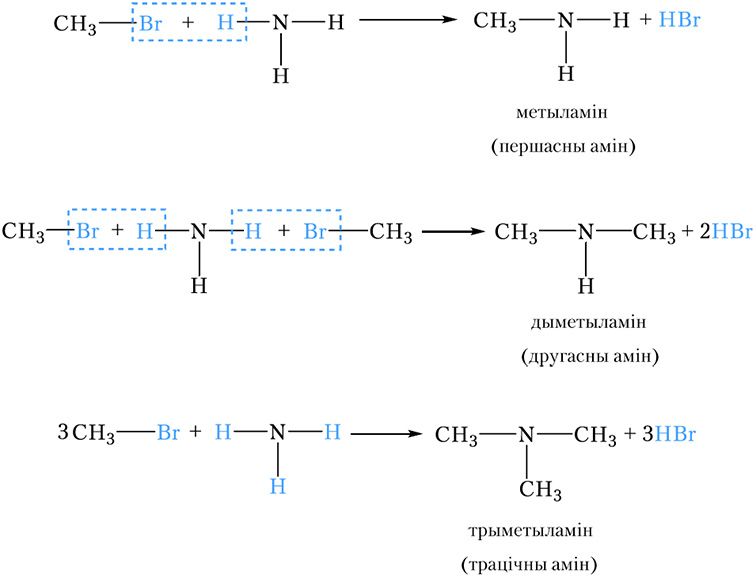
2. Атрыманне амінаў узаемадзеяннем галагеналканаў з аміякам
Пры ўзаемадзеянні галагеналканаў з аміякам адбываецца замяшчэнне галагену на амінагрупу. Гэта рэакцыя была адкрыта нямецкім хімікам А. В. Гофманам. У рэакцыі, як і ў выпадку спіртоў, акрамя першасных амінаў утвараюцца таксама другасныя і трацічныя аміны:
Пытанні і заданні

1. Арганічнае рэчыва А растварылі ў вадзе. У атрыманы раствор дабавілі некалькі кропель фенолфталеіну. У выніку раствор набыў малінавую афарбоўку. Укажыце формулу рэчыва А.
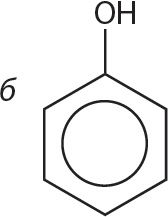
Прывядзіце ўраўненне рэакцыі, якая працякае, пры растварэнні рэчыва А ў вадзе.
2. Напішыце ўраўненне рэакцыі паміж этыламінам (2 моль) і растворам сернай кіслаты (1 моль). Назавіце прадукт рэакцыі.
3. Як можна атрымаць анілін, выкарыстоўваючы ў якасці зыходнага рэчыва бензол? Напішыце ўраўненні адпаведных рэакцый.
4. У колбу змясцілі нітрабензол, бромавадародную кіслату (лішак) і жалезнае пілавінне. Пры гэтым утварылася арганічнае рэчыва Х, масавая доля брому ў якім роўна 46,0 %.
а) Напішыце ўраўненне рэакцыі, якая працякае, і назавіце рэчыва X.
б) Напішыце малекулярнае і іоннае ўраўненні рэакцыі рэчыва X з гідраксідам натрыю ў водным растворы.
в) Напішыце малекулярнае і іоннае ўраўненні рэакцыі рэчыва X з нітратам серабра ў водным растворы.
5. Цвёрдае, растваральнае ў вадзе арганічнае рэчыва А пры ўзаемадзеянні з водным растворам нітрату серабра ўтварае белы тварожысты асадак. Пры дзеянні гідраксіду калію на рэчыва А ўтвараецца злучэнне В, бясколерная алеістая вадкасць, маларастваральная ў вадзе. Пры дзеянні бромнай вады на В утвараецца белы асадак рэчыва С. Масавая доля азоту ў рэчыве А роўна 10,8 %. Што ўяўляюць сабой рэчывы А, В і С? Прывядзіце іх формулы і ўраўненні апісаных рэакцый.
6. Дадзена схема ператварэнняў:
![]()
Напішыце ўраўненні рэакцый, якія працякаюць.
7. Пры згаранні 0,45 г арганічнага рэчыва вылучылася 0,448 л (н. у.) вуглякіслага газу, 0,63 г вады і 0,112 л (н. у.) азоту. Адносная шчыльнасць пароў арганічнага рэчыва па азоту роўна 1,607. Устанавіце малекулярную формулу гэтага рэчыва.
8. Некаторае арганічнае злучэнне акрамя вугляроду і вадароду змяшчае азот, масавая доля якога 23,7 %. Гэта злучэнне ўзаемадзейнічае з салянай кіслатой з утварэннем солі, яго малекула змяшчае два вуглевадародныя радыкалы і адзін атам азоту. На падставе гэтых даных:
а) Устанавіце малекулярную формулу арганічнага злучэння.
б) Састаўце яго структурную формулу.
в) Прывядзіце ўраўненне рэакцыі яго ўзаемадзеяння з салянай кіслатой.
9*. Ці можна атрымаць метыламін узаемадзеяннем метану з аміякам? Коратка растлумачце свой адказ.
10*. Прапануйце схему атрымання метыламіну, зыходзячы з метану і неарганічных рэчываў. Напішыце ўраўненні адпаведных рэакцый.
11*. Прапануйце схему атрымання этыламіну, зыходзячы з этылену, вады і аміяку. Напішыце ўраўненні адпаведных рэакцый.
