§ 32. Насычаныя аднаасноўныя карбонавыя кіслоты. Наменклатура. Ізамерыя. Фізічныя ўласцівасці
| Сайт: | Профильное обучение |
| Курс: | Хімія. 10 клас |
| Книга: | § 32. Насычаныя аднаасноўныя карбонавыя кіслоты. Наменклатура. Ізамерыя. Фізічныя ўласцівасці |
| Напечатано:: | Гость |
| Дата: | Суббота, 5 Июль 2025, 02:49 |
Насычаныя аднаасноўныя карбонавыя кіслоты.
У малекуле першага прадстаўніка гамалагічнага рада насычаных аднаасноўных карбонавых кіслот карбаксільная група звязана з атамам вадароду:
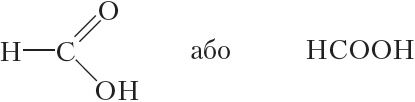
Як вы ўжо ведаеце, гэта злучэнне называецца мурашыная кіслата. Мурашыная кіслата ўпершыню была вылучана з лясных мурашак, чым і абумоўлена яе назва. У прыродзе мурашыная кіслата сустракаецца таксама ў крапіве, некаторай садавіне, едкіх выдзяленнях медуз і г. д. Мурашыная кіслата пры пакаёвай тэмпературы ўяўляе сабой бясколерную вадкасць з рэзкім пахам, тэмпература кіпення 101 °С.
Формула наступнага прадстаўніка гамалагічнага рада насычаных аднаасноўных карбонавых кіслот:
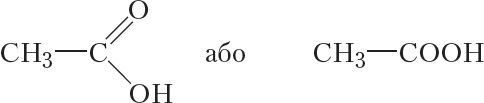
Гэта злучэнне называецца воцатная кіслата. Воцатная кіслата, таксама як і мурашыная, пры пакаёвай тэмпературы — бясколерная вадкасць з рэзкім пахам. Тэмпература кіпення воцатнай кіслаты складае 118 °С.
Малекулы гамолагаў воцатнай кіслаты адрозніваюцца ад яе на адну або некалькі груп CH2 і маюць агульную формулу CnH2n+1 ![]() COOH.
COOH.
Вядомы гамолагі воцатнай кіслаты, вуглевадародны радыкал якіх уключае дастаткова доўгі ланцуг з атамаў вугляроду. Важнейшымі прадстаўнікамі такіх кіслот з’яўляюцца пальміцінавая С15Н31 ![]() СООН і стэарынавая С17Н35
СООН і стэарынавая С17Н35 ![]() СООН.
СООН.
У малекулах пальміцінавай і стэарынавай кіслот вуглевадародныя радыкалы маюць неразгалінаваную будову. Шарастрыжнёвая мадэль малекулы пальміцінавай кіслаты:
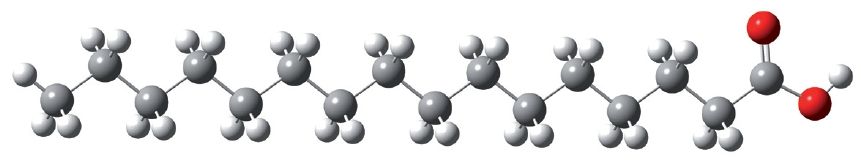
Пальміцінавая і стэарынавая кіслоты выдзелены з прадуктаў перапрацоўкі тлушчаў і атрымалі назву вышэйшыя тлустыя кіслоты.
Гэтыя кіслоты ўяўляюць сабой цвёрдыя бясколерныя рэчывы, нерастваральныя ў вадзе. Тэмпературы плаўлення пальміцінавай і стэарынавай кіслот складаюць 63 і 70 °С адпаведна.
Ізамерыя
Для карбонавых кіслот магчыма ізамерыя вугляроднага шкілета. Гэты від ізамерыі, таксама як і ў выпадку альдэгідаў, з’яўляецца пачынаючы з рэчыва, якое змяшчае чатыры атамы вугляроду ў малекуле:
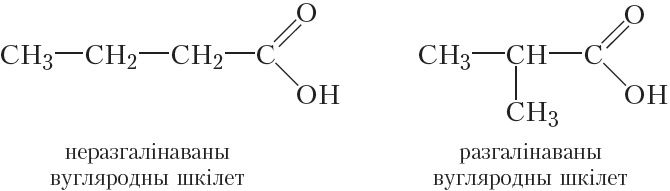
Так як карбаксільная група заўсёды размяшчаецца ў пачатку малекулы, то ізамерыя, звязаная са становішчам карбаксільнай групы, немагчыма.
Наменклатура
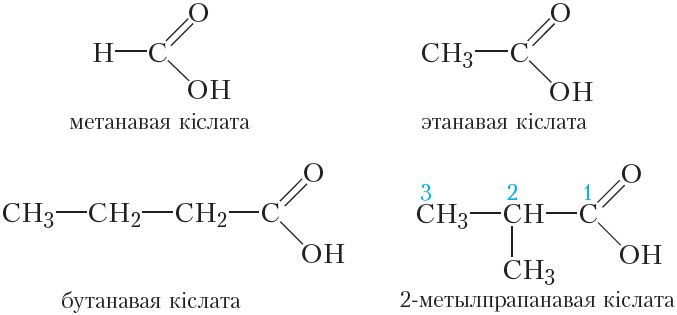
Назвы мурашыная і воцатная кіслоты з’яўляюцца назвамі, якія гістарычна склаліся, або трывіяльнымі назвамі. Па сістэматычнай наменклатуры карбаксільная група абазначаецца спалучэннем «-авая кіслата». Назва кіслаты складаецца з назвы алкану з тым самым, што і ў кіслаты, лікам атамаў вугляроду ў малекуле і канчатка «-авая кіслата». Нумарацыю атамаў вугляроду галоўнага ланцуга заўсёды пачынаюць з атама вугляроду карбаксільнай групы.
Назавём усе ўпамянутыя вышэй карбонавыя кіслоты:
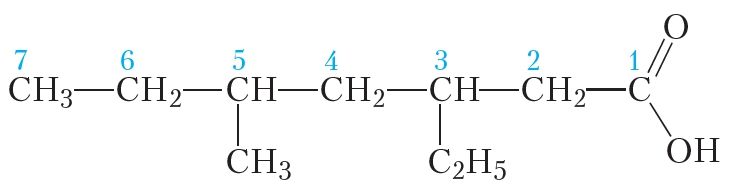
Выкарыстоўваючы правілы сістэматычнай наменклатуры можна назваць карбонавыя кіслоты, малекулы якіх маюць больш складаную будову, напрыклад:
карбонавых кіслот
і складаных эфіраў
Галоўны ланцуг складаецца з сямі атамаў вугляроду. Адпаведны алкан называецца гептан. Трэці і пяты атамы вугляроду галоўнага ланцуга звязаны з алкільнымі радыкаламі, назвы якіх пералічваюцца ў алфавітным парадку. Прыналежнасць злучэння да класа карбонавых кіслот указваем пры дапамозе спалучэння «-авая кіслата». Тады назва карбонавай кіслаты — 5-метыл-3-этылгептанавая кіслата.
З міжкласавай ізамерыяй карбонавых кіслот і складаных эфіраў вы можаце пазнаёміцца, перайшоўшы па спасылцы ў QR-кодзе.
Фізічныя ўласцівасці
У табліцы 32.1 прыведзены формулы, назвы і тэмпературы кіпення некаторых карбонавых кіслот.
| Формула | Назва | tкіп, °С |
| H |
метанавая кіслата | 101 |
| CH3 |
этанавая кіслата | 118 |
| CH3 |
прапанавая кіслата | 141 |
| CH3 |
бутанавая кіслата | 164 |
| CH3 |
пентанавая кіслата | 185 |
Як бачна з даных табліцы, тэмпературы кіпення карбонавых кіслот значна вышэйшыя, чым у альдэгідаў з тым самым лікам атамаў вугляроду ў малекуле. У адрозненне ад альдэгідаў, сярод карбонавых кіслот няма газападобных пры пакаёвай тэмпературы рэчываў. Адсутнасць газападобных рэчываў мы ўжо сустракалі ў гамалагічным радзе аднаатамных спіртоў (§ 23). У параграфе 23 указана прычына высокіх тэмператур кіпення спіртоў — утварэнне паміж іх малекуламі вадародных сувязей. Утварэнне вадародных сувязей паміж малекуламі спіртоў магчыма дзякуючы наяўнасці палярных груп ![]() OH.
OH.
У малекулах карбонавых кіслот, як і ў спіртах, маецца група ![]() OH:
OH:
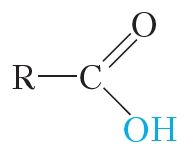
Таму паміж малекуламі карбонавых кіслот таксама ўтвараюцца вадародныя сувязі:
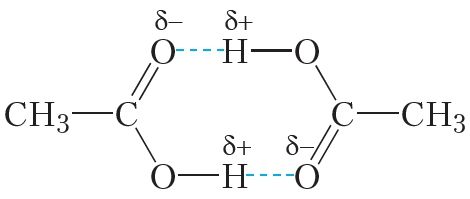
Вадародныя сувязі дастаткова моцна ўтрымліваюць малекулы карбонавых кіслот адну каля адной і робяць цяжкім пераход у газападобны стан, таму карбонавыя кіслоты маюць высокія тэмпературы кіпення.
Найпрасцейшыя прадстаўнікі карбонавых кіслот пры звычайных умовах уяўляюць сабой вадкасці з рэзкім пахам. З павелічэннем памеру вуглевадароднага радыкала тэмпературы кіпення карбонавых кіслот павялічваюцца. Вышэйшыя карбонавыя кіслоты — пальміцінавая і стэарынавая — цвёрдыя рэчывы.
Мурашыная, воцатная і прапанавая кіслоты змешваюцца з вадой у любых суадносінах, гэта значыць можна прыгатаваць водныя растворы гэтых кіслот любога саставу. Па меры павелічэння колькасці атамаў вугляроду ў вуглевадародным радыкале растваральнасць карбонавых кіслот у вадзе памяншаецца. Вышэйшыя карбонавыя кіслоты — пальміцінавая і стэарынавая — у вадзе нерастваральныя.
Па сістэматычнай наменклатуры карбаксільная група абазначаецца спалучэннем «-авая кіслата».
У адпаведнасці з сістэматычнай наменклатурай назва карбонавай кіслаты складаецца з назвы вуглевадароду з тым самым, што і ў кіслаты, лікам атамаў вугляроду ў малекуле і канчатка «-авая кіслата». Нумарацыю атамаў вугляроду галоўнага ланцуга пачынаюць з атама вугляроду карбаксільнай групы.
Паміж малекуламі карбонавых кіслот утвараюцца вадародныя сувязі, што абумоўлівае іх высокія тэмпературы кіпення.
*Міжкласавая ізамерыя карбонавых кіслот і складаных эфіраў
Для карбонавых кіслот магчыма міжкласавая ізамерыя са складанымі эфірамі. Напрыклад, воцатная кіслата ізамерна метылаваму эфіру мурашынай кіслаты (метылфарміату):
![]()
Як відаць, састаў абодвух рэчываў можа быць выражаны аднолькавай малекулярнай формулай C2H4O2.
Існуе два складаныя эфіры, якія ізамерны прапанавай кіслаце:
![]()
Усім тром рэчывам адпавядае малекулярная формула С3Н6 О2.
Больш падрабязна аб пабудове назваў складаных эфіраў вы можаце прачытаць у §38.
Пытанні і заданні
1. Укажыце шарастрыжнёвую мадэль прапанавай кіслаты:
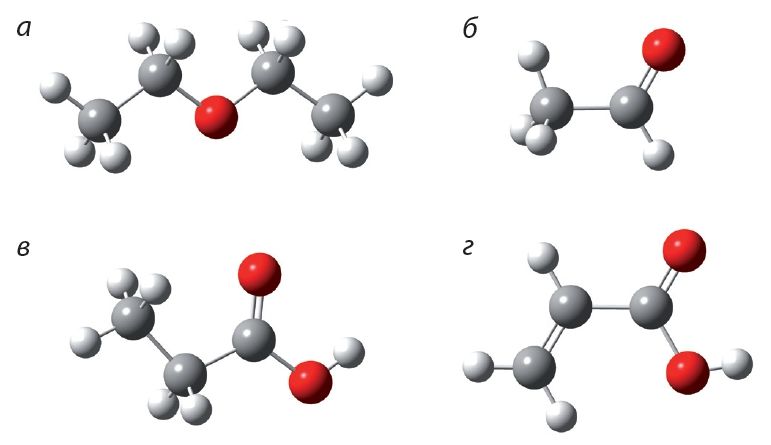
Напішыце структурныя формулы аднаасноўных карбонавых кіслот саставу С5Н10О2 і назавіце іх па сістэматычнай наменклатуры.
2. На малюнку прыведзены мадэлі малекул мурашынай і воцатнай кіслот:
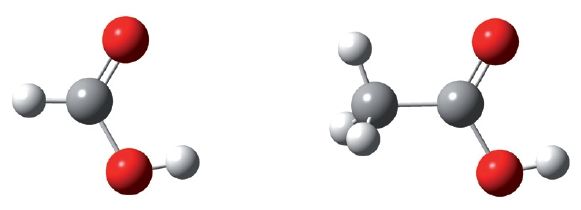
Укажыце тыпы гібрыдызацыі атамаў вугляроду ў малекулах гэтых злучэнняў і прыблізныя значэнні валентных вуглоў.
3. Размясціце ў парадку павелічэння тэмпературы кіпення наступныя рэчывы: этанол, воцатны альдэгід, воцатная кіслата. Адказ растлумачце.
4. Адлюструйце ўтварэнне вадародных сувязей паміж малекуламі воцатнай кіслаты і вады.
5. За кошт утварэння вадародных сувязей у пары мурашыная кіслата існуе як у выглядзе асобных малекул, так і ў выглядзе цыклічных дымераў:
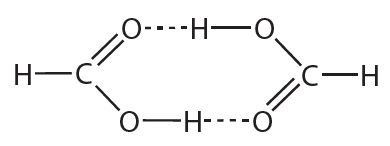
Вызначце сярэднюю малярную масу пары, якая складаецца з мурашынай кіслаты і яе дымера, калі вядома, што ў пары на 100 малекул мурашынай кіслаты прыходзіцца 30 малекул дымера.
