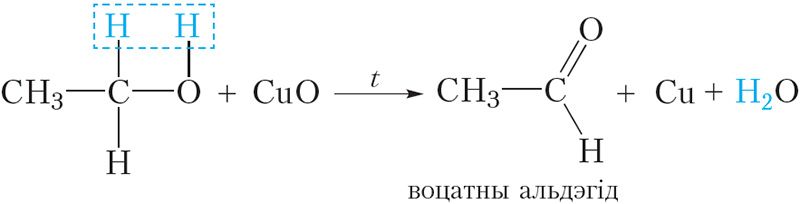§ 24. Хімічныя ўласцівасці, атрыманне і прымяненне спіртоў
Хімічныя ўласцівасці, атрыманне і прымяненне спіртоў
Многія хімічныя ўласцівасці спіртоў вызначаюцца наяўнасцю ў іх малекулах гідраксільнай групы, таму гідраксільную групу называюць функцыянальнай.
Разгледзім хімічныя ўласцівасці насычаных аднаатамных спіртоў.
1. Узаемадзеянне са шчолачнымі металамі
Калі ў стакан з этылавым спіртам змясціць кавалачак натрыю, пачнецца бурная рэакцыя, якая суправаджаецца вылучэннем вадароду:
![]()
У гэтай рэакцыі адбываецца замяшчэнне атама вадароду гідраксільнай групы атамам металу.
Таксама рэагуюць з натрыем і іншыя спірты. Прывядзём ураўненне рэакцыі прапанолу-1 з натрыем:
![]()
Пры ўзаемадзеянні з актыўнымі металамі спірты праяўляюць кіслотныя ўласцівасці. Кіслотныя ўласцівасці спіртоў выяўлены вельмі слаба (слабей, чым у вады!), таму спірты не змяняюць афарбоўку індыкатараў, не рэагуюць са шчолачамі і могуць узаемадзейнічаць толькі з самымі актыўнымі металамі, напрыклад са шчолачнымі металамі натрыем і каліем.
Прадукты замяшчэння атама вадароду гідраксільнай групы спірту атамам металу называюцца алкагалятамі. Прывядзём назвы некаторых алкагалятаў:
![]()
Алкагаляты ўяўляюць сабой цвёрдыя солепадобныя рэчывы. Яны раскладаюцца вадой з утварэннем спірту і шчолачы:
![]()
2. Узаемадзеянне з галагенавадародамі
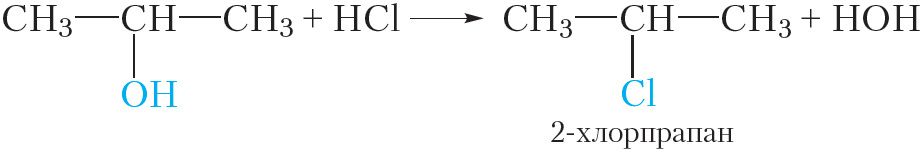
Спірты ўзаемадзейнічаюць з галагенавадародамі (HCl, HBr, HI). Пры гэтым гідраксільная група замяшчаецца на галаген. Прывядзём ураўненне рэакцыі этылавага спірту з бромавадародам:
![]()
Таксама рэагуюць з галагенавадародамі і іншыя спірты. Напрыклад, пры ўзаемадзеянні прапанолу-1 з хлоравадародам адбываецца замяшчэнне гідраксільнай групы і ўтвараецца 2-хлорпрапан:
3. Дэгідратація. Адшчапленне вады
Пры награванні з моцнымі водааднімаючымі сродкамі, такімі як канцэнтраваная серная кіслата, ад спіртоў адшчапляецца малекула вады. Рэакцыя адшчаплення малекулы вады называецца рэакцыяй дэгідратацыі (§ 16).
Прывядзём ураўненні рэакцый дэгідратацыі этанолу і прапанолу-2:
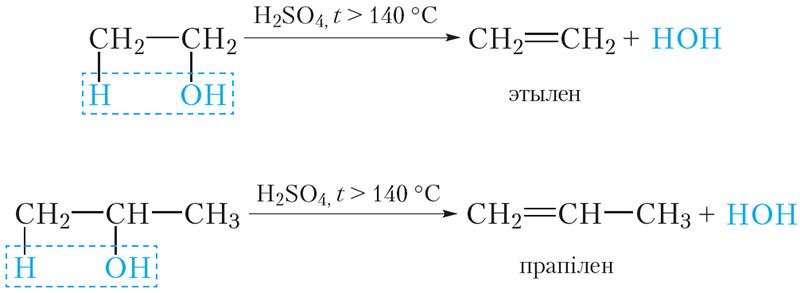
У дадзеных рэакцыях ад адной малекулы спірту адшчапляецца адна малекула вады. Такая рэакцыя называецца ўнутрымалекулярнай дэгідратацыяй. У выніку ўнутрымалекулярнай дэгідратацыі спіртоў утвараюцца алкены.
Пры менш моцным награванні адна малекула вады можа адшчапляцца ад двух малекул спірту:
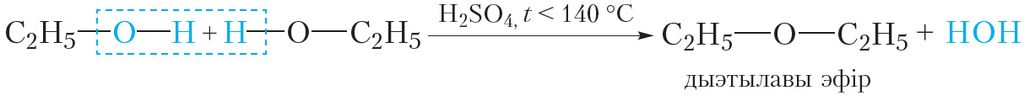
Гэта рэакцыя называецца міжмалекулярнай дэгідратацыяй.
У выніку міжмалекулярнай дэгідратацыі спіртоў утвараюцца простыя эфіры. Будову простых эфіраў можна выразіць наступнай формулай: R ![]() O
O ![]() R′. Вуглевадародныя радыкалы ў малекуле простага эфіру могуць быць аднолькавымі або рознымі. Простыя эфіры ізамерныя спіртам (§ 22).
R′. Вуглевадародныя радыкалы ў малекуле простага эфіру могуць быць аднолькавымі або рознымі. Простыя эфіры ізамерныя спіртам (§ 22).
Прадукт рэакцыі міжмалекулярнай дэгідратацыі этылавага спірту — дыэтылавы эфір, уяўляе сабой бясколерную вадкасць са спецыфічным пахам і нізкай тэмпературай кіпення (tкіп = 35 °С). Ён выкарыстоўваецца ў медыцынскай практыцы для наркозу і дэзінфекцыі скуры пры правядзенні ін’екцый.
Прывядзём ураўненне рэакцыі міжмалекулярнай дэгідратацыі метанолу.
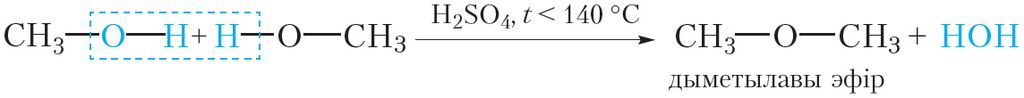
Пры гэтым утвараецца дыметылавы эфір — газападобнае пры нармальных умовах рэчыва з тэмпературай кіпення –25 °С.
Звярніце ўвагу, што тэмпературы кіпення простых эфіраў намнога ніжэйшыя, чым ізамерных спіртоў. На малюнку 24.1 паказаны шарастрыжнёвыя мадэлі малекул этанолу і дыметылавага эфіру і ўказаны іх тэмпературы кіпення.
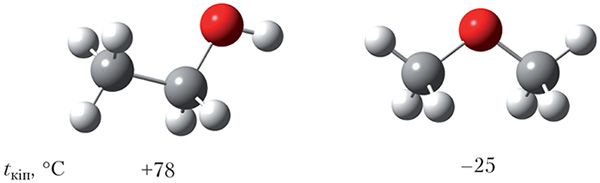
і іх тэмпературы кіпення
Этанол і дыметылавы эфір з’яўляюцца ізамерамі, іх малекулы маюць прыкладна аднолькавыя памеры, таму, здавалася б, тэмпературы кіпення павінны быць блізкія. Тым не менш, тэмпература кіпення этанолу больш чым на 100 °С вышэй, чым тэмпература кіпення дыметылавага эфіру. Нагадаем, што высокія тэмпературы кіпення спіртоў тлумачацца ўтварэннем вадародных сувязей паміж іх малекуламі. Вадародная сувязь утвараецца паміж атамам вадароду гідраксільнай групы адной малекулы спірту і атамам кіслароду другой малекулы. Паміж малекуламі простых эфіраў вадародныя сувязі не ўтвараюцца, так як у малекулах простых эфіраў няма гідраксільных груп.
4. Акісленне
Спірты гараць пры падпальванні, у гэтым мы можам пераканацца, запальваючы спіртоўку:
![]()
Акісленне этанолу
аксідам медзі(II)
У выніку ўтвараюцца вуглякіслы газ і вада. Такая рэакцыя называецца поўным акісленнем.
Магчыма і няпоўнае акісленне спіртоў. Яго можна ажыццявіць наступным чынам. Нагрэем у полымі спіртоўкі медны дрот да чырвонага напальвання. Пры гэтым бліскучая паверхня дроту пакрыецца чорным налётам аксіду медзі(II) з прычыны акіслення медзі:
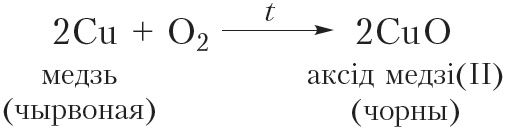
Пасля гэтага распалены дрот хутка змесцім у шклянку з невялікай колькасцю этылавага спірту. Дрот пры гэтым зноў становіцца бліскучым (відэа 24.1). Гэта сведчыць аб тым, што з чорнага аксіду медзі(II) ўтварылася медзь. Значыць адбылося аднаўленне аксіду медзі(II). Адноўнікам з’яўляецца этылавы спірт. У ходзе рэакцыі ён акісляецца да воцатнага альдэгіду: