§ 18. Алкіны
Алкіны
Атамы вугляроду могуць быць звязаны паміж сабой не толькі адзінарнымі ці двайнымі, але таксама трайнымі сувязямі. Найпрасцейшым вуглевадародам, які змяшчае трайную сувязь, з’яўляецца этын, або ацэтылен, НC ![]() СН. Разгледзім яго будову.
СН. Разгледзім яго будову.
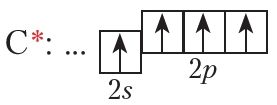
Кожны атам вугляроду ў ацэтылене ўтварае чатыры хімічныя сувязі. Утварэнне гэтых сувязей адбываецца за кошт чатырох атамных арбіталей:
Успомнім будову этылену: 
Атамы вугляроду ў гэтай малекуле знаходзяцца ў стане sp2-гібрыдызацыі. За кошт sp2-гібрыдных арбіталей кожны атам вугляроду ўтварае тры σ-сувязі: дзве сувязі з атамамі вадароду і адну — з суседнім вугляродам:
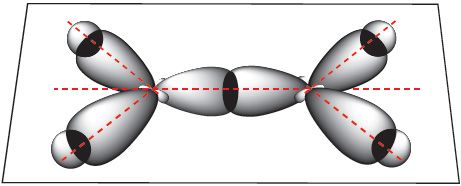
Другая сувязь паміж атамамі вугляроду ўтвараецца за кошт бакавога перакрывання негібрыдных p-арбіталей атамаў вугляроду — гэта π-сувязь:
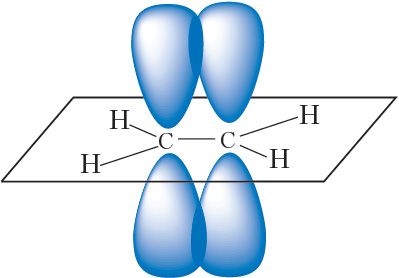
Такім чынам, двайная сувязь складаецца з адной σ- і адной π-сувязі.
У малекуле ацэтылену Н ![]() С
С ![]() С
С ![]() Н маецца трайная сувязь. Яна складаецца з адной σ- і двух π-сувязей. Так як π-сувязі ўтвараюцца за кошт перакрывання негібрыдных p-арбіталей, то ў гібрыдызацыі будуць прымаць удзел адна s- і адна p-арбіталі атамаў вугляроду. Такі тып гібрыдызацыі называецца sp-гібрыдызацыя.
Н маецца трайная сувязь. Яна складаецца з адной σ- і двух π-сувязей. Так як π-сувязі ўтвараюцца за кошт перакрывання негібрыдных p-арбіталей, то ў гібрыдызацыі будуць прымаць удзел адна s- і адна p-арбіталі атамаў вугляроду. Такі тып гібрыдызацыі называецца sp-гібрыдызацыя.
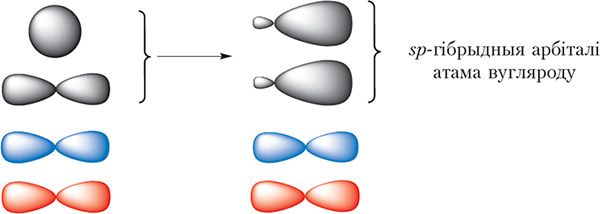
sp-Гібрыдныя арбіталі размяшчаюцца на адной прамой пад вуглом 180°. Дзве р-арбіталі атама вугляроду, якія не ўдзельнічаюць у гібрыдызацыі, захоўваюць сваю першапачатковую форму і размяшчаюцца ўзаемна перпендыкулярна:
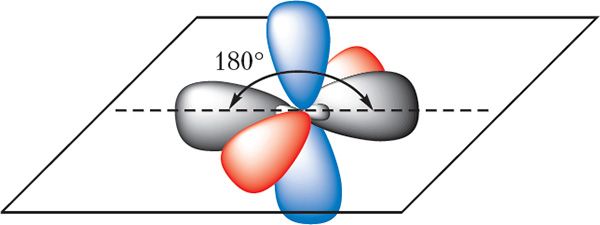
За кошт перакрывання гібрыдных арбіталей кожны атам вугляроду ўтварае дзве σ-сувязі — адну сувязь з атамам вадароду і адну — з суседнім вугляродам:

у малекуле ацэтылену
Арбіталі, якія не ўдзельнічаюць у гібрыдызацыі, фарміруюць дзве π-сувязі паміж атамамі вугляроду:
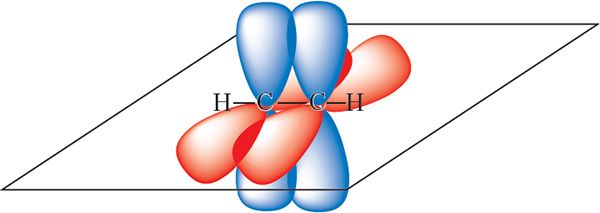
у малекуле ацэтылену
Такім чынам, у малекуле ацэтылену маюцца тры σ-сувязі і дзве π-сувязі:

Малекула ацэтылену лінейная, валентны вугал роўны 180°. Сувязь паміж атамамі вугляроду трайная:
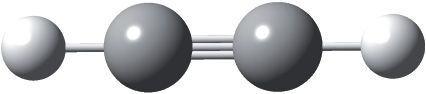
Трайная сувязь карацейшая, чым двайная і адзінарная: у малекуле ацэтылену даўжыня сувязі паміж атамамі вугляроду роўная 0,120 нм. Нагадаем, што ў малекулах этылену і этану даўжыня сувязі паміж атамамі вугляроду складае 0,134 і 0,154 нм адпаведна.
Ацэтылен з’яўляецца найпрасцейшым прадстаўніком алкінаў — нецыклічных вуглевадародаў, малекулы якіх змяшчаюць адну трайную сувязь.
Бліжэйшы гамолаг ацэтылену — прапін СН3 ![]() C
C ![]() СН. Малекулярная формула прапіну С3Н4. Так як суседнія члены гамалагічнага рада адрозніваюцца па саставе на групу СН2, відавочна, што наступны гамолаг павінен мець састаў С4Н6. Адсюль лёгка можна вывесці агульную формулу алкінаў — СnH2n–2. Як вы ўжо ведаеце, агульную формулу СnH2n–2 маюць таксама алкадыены.
СН. Малекулярная формула прапіну С3Н4. Так як суседнія члены гамалагічнага рада адрозніваюцца па саставе на групу СН2, відавочна, што наступны гамолаг павінен мець састаў С4Н6. Адсюль лёгка можна вывесці агульную формулу алкінаў — СnH2n–2. Як вы ўжо ведаеце, агульную формулу СnH2n–2 маюць таксама алкадыены.