§ 11. Устанаўленне формулы арганічнага рэчыва
| Сайт: | Профильное обучение |
| Курс: | Хімія. 10 клас |
| Книга: | § 11. Устанаўленне формулы арганічнага рэчыва |
| Напечатано:: | Гость |
| Дата: | Суббота, 5 Июль 2025, 18:21 |
Устанаўленне формулы арганічнага рэчыва
Устанаўленне будовы хімічнага злучэння з’яўляецца прадметам навуковага даследавання. Складанасць дадзенай праблемы залежыць ад складанасці будовы злучэння. Першым этапам даследавання, як правіла, з’яўляецца вызначэнне малекулярнай формулы рэчыва. Разгледзім некаторыя спосабы ўстанаўлення формул арганічных рэчываў на дастаткова простых прыкладах.
Прыклад 1. Больш за два стагоддзі таму хімікі ўжо ўмелі вызначаць якасны і колькасны састаў рэчываў. Напрыклад, было вядома, што ў састаў аднаго з арганічных рэчываў уваходзяць вуглярод і вадарод, прычым масавая доля вугляроду складае 75 %, а вадароду — 25 %. Гэта значыць, у 100 г рэчыва змяшчаецца 75 г вугляроду і 25 г вадароду. Выкарыстоўваючы гэтыя даныя, вызначце формулу арганічнага рэчыва.
Паколькі невядомае арганічнае рэчыва складаецца толькі з вугляроду і вадароду, то яго малекулярную формулу можна прадставіць у выглядзе СхHy. Такім чынам, рашэнне задачы зводзіцца да знаходжання індэксаў x і у у формуле рэчыва. Індэксы x і y у формуле паказваюць колькасці атамаў вугляроду і вадароду ў малекуле арганічнага рэчыва, таму на першым этапе рашэння падобных задач неабходна знайсці найпрасцейшыя цэлалікавыя суадносіны паміж колькасцю атамаў вугляроду і вадароду ў невядомым рэчыве:
![]()
Па ўмове, маса атамаў вугляроду роўна 75 г, вадароду — 25 г. Тады:
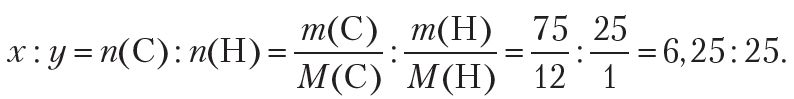
Дакладнасць прамежкавых вылічэнняў павінна адпавядаць дакладнасці зыходных даных, гэта значыць прамежкавыя значэнні павінны змяшчаць не менш значных лічбаў, чым даныя задачы.
Відавочна, што атрыманыя суадносіны не з’яўляюцца цэлалікавымі. Каб атрымаць цэлалікавыя значэнні індэксаў x і y, выконваюць наступныя дзеянні: спачатку ўсе лікі атрыманых суадносін дзеляць на найменшае (у адным выпадку ўжо будзе адзінка) і пры неабходнасці памнажаюць атрыманыя лікі на натуральны лік (2, 3 і г. д.) для атрымання цэлалікавых суадносін:
![]()
Тады формула злучэння — CH4. Гэта рэчыва нам добра вядома, яно называецца метан.
Адказ: СН4.
Прыклад 2. Некаторае арганічнае рэчыва складаецца з вугляроду і вадароду. Масавая доля вугляроду ў рэчыве складае 82,8 %. Устанавіце малекулярную формулу рэчыва.
Паколькі невядомае арганічнае рэчыва складаецца толькі з вугляроду і вадароду, то яго формула СхHy. Ва ўмове задачы дадзены масавыя долі элементаў у рэчыве. У такіх выпадках пры рашэнні задачы зручна разгледзець пэўную масу рэчыва, якую звычайна прымаюць роўнай 100 г. У гэтым выпадку масавыя долі элементаў будуць супадаць па велічыні з іх масамі. Тады найпрасцейшыя цэлалікавыя суадносіны індэксаў у формуле рэчыва:
![]()
Такім чынам, найпрасцейшая формула арганічнага рэчыва — С2Н5. Устойлівага арганічнага рэчыва з такой формулай не існуе. Сапраўды, формула С2Н5 адпавядае этыльнаму радыкалу. Каб вызначыць сапраўдную формулу арганічнага рэчыва, будзем улічваць, што падваенне, патраенне і г. д. індэксаў у формуле не змяняе суадносіны паміж імі. Падвоіўшы індэксы ў найпрасцейшай формуле С2Н5, атрымаем формулу С4Н10. Гэта формула адпавядае вуглевадароду бутану. Такім чынам, сапраўдная формула рэчыва — С4Н10.
Адказ: С4Н10.
У разгледжаных прыкладах для вызначэння формулы арганічнага рэчыва нам было дастаткова ведаць толькі масавыя долі элементаў у рэчыве. У той жа час, у некаторых выпадках, ведаючы толькі масавыя долі элементаў у рэчыве, можна вызначыць толькі найпрасцейшую, але не сапраўдную формулу. У такіх выпадках для ўстанаўлення сапраўднай формулы неабходны дадатковыя даныя. Як правіла, гэта звесткі аб малярнай масе злучэння.
Прыклад 3. Малярная маса вуглевадароду роўна 42 г/моль. Масавая доля вугляроду ў вуглевадародзе складае 85,7 %. Устанавіце малекулярную формулу вуглевадароду.
Формула вуглевадароду — СхHy. Знойдзем найпрасцейшыя цэлалікавыя суадносіны індэксаў у формуле рэчыва:
![]()
Такім чынам, найпрасцейшая формула вуглевадароду — СН2. Падвоіўшы індэксы ў найпрасцейшай формуле СН2, атрымаем формулу С2Н4. Гэта формула адпавядае вуглевадароду этылену. Калі патроіць індэксы ў найпрасцейшай формуле СН2, то атрымаецца формула С3Н6. Дадзеная формула адпавядае вуглевадароду прапілену. Гэта значыць, знойдзеным суадносінам індэксаў адпавядае мноства рэчываў, таму ў дадзеным выпадку, выкарыстоўваючы толькі масавыя долі элементаў, немагчыма ўстанавіць сапраўдную формулу рэчыва.
Для ўстанаўлення сапраўднай формулы параўнаем малярную масу вуглевадароду з малярнай масай найпрасцейшай формулы CH2:
![]()
Такім чынам, каб атрымаць сапраўдную формулу, неабходна павялічыць індэксы ў найпрасцейшай формуле CH2 у тры разы. Тады сапраўдная формула вуглевадароду — C3H6.
Адказ: С3Н6.
У саставе арганічных злучэнняў, разам з вугляродам і вадародам, часта прысутнічае кісларод. Выведзем малекулярную формулу кіслародзмяшчальнага злучэння.
Прыклад 4. Устанавіце найпрасцейшую формулу рэчыва, якое змяшчае 37,50 % вугляроду, 12,50 % вадароду і 50,00 % кіслароду (па масе).
Найпрасцейшыя цэлалікавыя суадносіны індэксаў у формуле рэчыва:
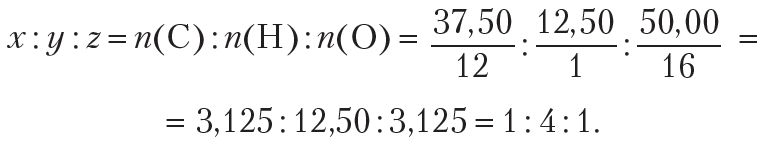
Найпрасцейшая формула рэчыва — СН4О. Гэтай малекулярнай формуле адпавядае метылавы спірт СН3![]() ОН.
ОН.
Адказ: СН4О або СН3![]() ОН.
ОН.
У разгледжаных прыкладах для ўстанаўлення формул мы выкарыстоўвалі звесткі аб масавых долях элементаў у рэчыве. Формулу арганічнага рэчыва можна вывесці таксама на падставе даных эксперымента па спальванні пэўнай масы арганічнага рэчыва.
Прыклад 5. У выніку спальвання 1,50 г арганічнага рэчыва атрымана 2,20 г вуглякіслага газу і 0,90 г вады. Малярная маса рэчыва роўная 60 г/моль. Устанавіце формулу рэчыва.
Паколькі пры спальванні рэчыва ўтварыліся вуглякіслы газ і вада, то ў састаў рэчыва маглі ўваходзіць толькі атамы вугляроду, вадароду і кіслароду.
Тады формула рэчыва — СxHyOz. Суадносіны індэксаў у формуле будзем знаходзіць з умовы:
![]()
Саставім схему рэакцыі:
![]()
Са схемы рэакцыі бачна, што вуглярод з арганічнага рэчыва пераходзіць у CO2, вадарод — у H2O. Значыць, колькасці вугляроду і вадароду ў CO2 і H2O будуць такімі самымі, як у арганічным рэчыве.
Знойдзем колькасць вугляроду ў CO2:
![]()
У малекуле вады змяшчаецца два атамы вадароду, такім чынам, колькасць (моль) вадароду ў два разы большая, чым колькасць вады:
![]()
Вызначым колькасць (моль) атамаў кіслароду ў рэчыве. Для гэтага разлічым масы вугляроду і вадароду ў дадзенай порцыі рэчыва:
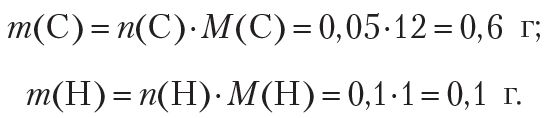
Разлічым масу і колькасць кіслароду ў рэчыве:
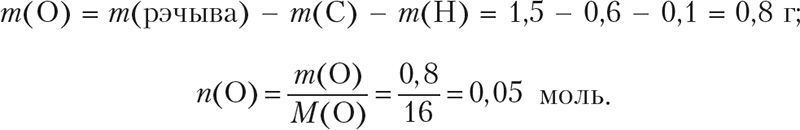
Найпрасцейшыя цэлалікавыя суадносіны індэксаў у формуле рэчыва:
![]()
Такім чынам, найпрасцейшая формула арганічнага рэчыва СН2O.
Для ўстанаўлення сапраўднай формулы параўнаем малярную масу рэчыва з малярнай масай найпрасцейшай формулы CH2O:
![]()
Значыць, каб атрымаць сапраўдную формулу, неабходна павялічыць індэксы ў найпрасцейшай формуле CH2O ў два разы. Тады сапраўдная формула рэчыва — C2H4O2. Адным з рэчываў, якія маюць такую малекулярную формулу, з’яўляецца воцатная кіслата СН3 ![]() СООН.
СООН.
Адказ: C2H4O2.
Абагульнім вышэйпададзенае. Ведаючы колькасці (моль) элементаў у рэчыве можна ўстанавіць найпрасцейшую формулу рэчыва. Для вываду сапраўднай формулы часта неабходны дадатковыя даныя, напрыклад звесткі аб малярнай масе рэчыва.
Вывад формулы арганічнага рэчыва звычайна складаецца з наступных этапаў:
а) вылічэнне колькасці (моль) элементаў у рэчыве;
б) вызначэнне найпрасцейшых цэлалікавых суадносін паміж вылічанымі колькасцямі элементаў — устанаўленне найпрасцейшай формулы рэчыва;
в) устанаўленне сапраўднай формулы рэчыва.
Для ўстанаўлення найпрасцейшай формулы дастаткова ведаць колькасці (моль) элементаў у рэчыве.
Для вызначэння сапраўднай формулы часта патрабуюцца дадатковыя даныя, напрыклад звесткі аб малярнай масе рэчыва.
Пытанні і заданні
1. Вуглевадарод змяшчае 81,8 % вугляроду па масе. Устанавіце формулу вуглевадароду.
2. Газападобны вуглевадарод мае шчыльнасць 0,714 г/дм3 (н. у.). Вызначце малярную масу вуглевадароду. Выведзіце яго малекулярную формулу.
3. Вуглевадарод змяшчае 83,72 % вугляроду і 16,28 % вадароду па масе. Устанавіце яго найпрасцейшую і сапраўдную формулы. Напішыце структурныя формулы ўсіх рэчываў, якія задавальняюць умове задачы.
4. Малярная маса рэчыва А роўна 72 г/моль. Пры згаранні 1,44 г гэтага рэчыва ў лішку кіслароду атрымалі вуглякіслы газ масай 4,4 г і ваду масай 2,16 г. Устанавіце малекулярную формулу рэчыва А і прывядзіце структурныя формулы ўсіх рэчываў, якія маюць такую малекулярную формулу.
5. У выніку спальвання ў кіслародзе арганічнага злучэння масай 1,38 г атрымана 2,64 г СО2 і 1,62 г вады. Устанавіце малекулярную формулу арганічнага злучэння, калі вядома, што яго малекула змяшчае адзін атам кіслароду. Напішыце магчымыя структурныя формулы гэтага злучэння.
6*. Вуглевадарод спалілі ў лішку кіслароду. Пасля выдалення лішку кіслароду газападобная сумесь прадуктаў згарання мае сярэднюю малярную масу, роўную 30 г/моль (110 °С, атмасферны ціск). Устанавіце малекулярную формулу вуглевадароду.
Вы можаце пазнаёміцца з цыклаалканамі — насычанымі вуглевадародамі, у малекулах якіх маецца цыкл з атамаў вугляроду, перайшоўшы па спасылцы ў QR-кодзе.
