§ 3. Тыпы хімічнай сувязі
| Сайт: | Профильное обучение |
| Курс: | Хімія. 10 клас |
| Книга: | § 3. Тыпы хімічнай сувязі |
| Напечатано:: | Гость |
| Дата: | Суббота, 5 Июль 2025, 06:32 |
Тыпы хімічнай сувязі
З курса хіміі 7–9-га класаў вы ведаеце, што пры звычайных умовах атамы большасці хімічных элементаў у свабодным выглядзе (па асобку) не існуюць. Нават у простых рэчывах атамы звязаны адзін з адным хімічнымі сувязямі. Выключэннем з’яўляюцца толькі высакародныя газы.
Напрыклад, простае рэчыва вадарод складаецца з малекул H2, у якіх два атамы вадароду звязаны адной кавалентнай сувяззю: Н ![]() Н.
Н.
Хімічная сувязь — узаемадзеянне, якое злучае асобныя атамы ў хімічныя злучэнні (малекулы або крышталі).
Удзельнічаць ва ўтварэнні хімічных сувязей могуць толькі тыя электроны, якія слабей звязаны з ядром, гэта значыць электроны знешняга энергетычнага ўзроўню. Такія электроны называюцца валентнымі.
Валентныя электроны прынята пазначаць кропкамі, якія акружаюць сімвал хімічнага элемента. Такія формулы называюцца электроннымі формуламі.
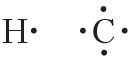
Відаць, што атамы вадароду і вугляроду маюць незавершаныя электронныя абалонкі, таму асобныя атамы вадароду і вугляроду не могуць існаваць пры звычайных умовах. У адрозненне ад іх, атамы высакародных газаў, якія маюць завершаныя электронныя абалонкі, устойлівыя. Электронныя формулы атамаў высакародных газаў гелію і неону наступныя:
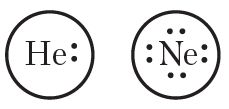
Акружнасць вакол электроннай формулы ўказвае на завершанасць знешняга слоя. Гэта значыць атам гелію мае завершаную двухэлектронную, а атам неону — васьміэлектронную знешнюю абалонку. Адсюль вынікае важная выснова — атамы будуць імкнуцца сфарміраваць стабільныя завершаныя электронныя абалонкі за кошт аддачы, далучэння або абагульнення электронаў. Пры гэтым утвараюцца хімічныя сувязі.
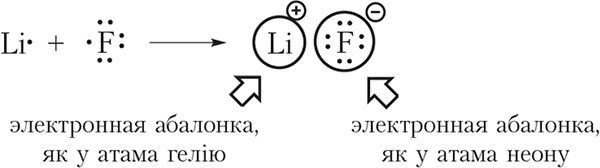
Прыклад 1. Утварэнне іоннай сувязі паміж літыем і фторам.
На знешнім электронным слоі атама літыю знаходзіцца адзін электрон, таму атам літыю лёгка аддае гэты электрон, набываючы завершаную электронную абалонку, як у бліжэйшага высакароднага газа — гелію. На знешнім слоі атама фтору размяшчаецца сем электронаў, таму фтор, наадварот, лёгка далучае адзін электрон, набываючы завершаную васьміэлектронную знешнюю абалонку, як у атама неону:
Пры ўтварэнні фтарыду літыю электрон ад атама літыю пераходзіць да атама фтору. У выніку ўтвараюцца іоны Li+ і F–. Электронныя канфігурацыі іонаў Li+ і F– такія самыя, як у атамаў гелію і неону адпаведна:
Li+: 1s2
F–: …2s23p6
Рознаіменна зараджаныя іоны прыцягваюцца адзін да аднаго. Такая сувязь называецца іоннай. Іонная сувязь утвараецца паміж атамамі металу і неметалу. Іонная сувязь маецца ў солях (NaCl, KF); аксідах металаў (Na2O, K2O); гідраксідах металаў (NaOH, KOH).
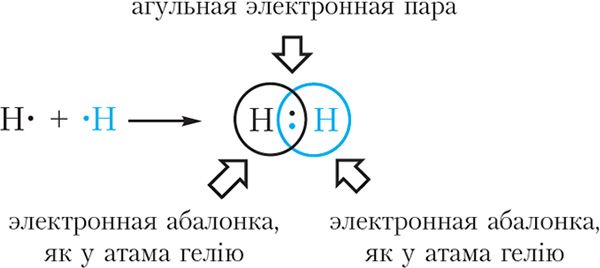
Прыклад 2. Утварэнне кавалентнай сувязі ў малекуле вадароду H2.
На знешнім слоі атама вадароду ёсць адзін няспараны электрон. Паколькі пры ўтварэнні малекулы вадароду паміж сабой узаемадзейнічаюць аднолькавыя атамы, электрон не будзе пераходзіць ад аднаго атама да другога і рознаіменна зараджаныя іоны ўтварацца не будуць. Замест гэтага няспараныя электроны двух атамаў вадароду ўтвараюць агульную электронную пару. Пры гэтым кожны атам вадароду набывае завершаную электронную абалонку, як у атама гелію:
Сувязь, утвораную з дапамогай агульных электронных пар, называюць кавалентнай. У формулах кавалентную сувязь (агульную электронную пару) абазначаюць рысачкай. Напрыклад, формулу малекулы вадароду можна запісаць H ![]() H. Такая формула называецца структурнай. Яна паказвае не толькі састаў, але і будову малекулы.
H. Такая формула называецца структурнай. Яна паказвае не толькі састаў, але і будову малекулы.
Кавалентная сувязь утвараецца паміж атамамі неметалаў. Кавалентная сувязь маецца ў простых рэчывах неметалаў (H2, Cl2, O2, N2); аксідах неметалаў (CO2, SO2); кіслотах (HCl, H2SO4).
Мы разгледзелі два тыпы хімічнай сувязі — кавалентную і іонную. Кавалентная сувязь утвараецца паміж атамамі неметалаў. Іоннай сувяззю злучаюцца металы з неметаламі.
Пры ўзаемадзеянні атамаў металаў адзін з адным узнікае трэці тып хімічнай сувязі — металічная сувязь. Падрабязна з гэтым тыпам сувязі вы знаёміліся ў курсе хіміі 9-га класа. Нагадаем, што металічная сувязь маецца ў простых рэчывах, утвораных металамі, напрыклад Na, K, Fe, і металічных сплавах.
Існуюць тры тыпы хімічнай сувязі: кавалентная, іонная і металічная.
Кавалентная сувязь утвараецца паміж атамамі неметалаў у простых рэчывах (H2, F2, O2), аксідах неметалаў (H2O, CO2), кіслотах (HF, HCl, H2SO4, HNO3).
Іонная сувязь утвараецца паміж атамамі металу і неметалу ў солях (NaCl, KF); аксідах металаў (K2O, BaO); гідраксідах металаў (NaOH, KOH).
Металічная сувязь утвараецца паміж атамамі металаў у простых рэчывах (Na, K, Cu) і металічных сплавах.
Пытанні і заданні
1. Чаму атамы большасці хімічных элементаў не існуюць пры звычайных умовах у свабодным выглядзе (у выглядзе не звязаных паміж сабой атамаў)? Ці ёсць выключэнне з гэтай заканамернасці?
2. Што такое валентныя электроны? Укажыце лік валентных электронаў у атамах вадароду, вугляроду, азоту.
3. Пры дапамозе электронных формул адлюструйце ўтварэнне кавалентных сувязей у малекулах F2 і N2. Электронную абалонку якога высакароднага газу набываюць атамы, што ўтварылі хімічную сувязь у дадзеных малекулах?
4. Вызначце тып хімічнай сувязі ў рэчывах: I2, H2O, KCl, Na2S, CO2, O2, CH4, Cu.