ЗАКЛЮЧЕНИЕ. ОТВЕТЫ
| Сайт: | Профильное обучение |
| Курс: | Химия. 10 класс |
| Книга: | ЗАКЛЮЧЕНИЕ. ОТВЕТЫ |
| Напечатано:: | Гость |
| Дата: | Среда, 25 Июнь 2025, 13:51 |
Заключение
Мы завершили изучение курса органической химии. Подведём краткий итог. Органическая химия — химия соединений углерода. Благодаря уникальному строению атома, в котором валентный уровень заполнен ровно наполовину, атомы углерода легко соединяются между собой достаточно прочными ковалентными связями с образованием линейных, разветвлённых цепей и циклов. Эти структуры могут содержать только одинарные связи, а также включать кратные (двойные и тройные) связи. Особый случай представляют собой ароматические соединения, содержащие циклы с чередующимися одинарными и двойными (сопряжёнными) связями. Если углеродный скелет дополняется атомами водорода, мы имеем дело с углеводородами, которых неисчерпаемое множество.
Несмотря на огромное разнообразие структур углеводородов, свойства их довольно немногочисленны. Углеводороды горят, этим обусловлено их практическое применение в качестве энергоносителей. Наиболее устойчивые углеводороды — алканы и арены — вступают в реакции замещения, в результате которых углеродный скелет сохраняется, а атомы водорода могут быть замещены на другие атомы, в частности на атомы галогенов. Молекулы алканов при высоких температурах и давлениях могут быть расщеплены на молекулы углеводородов с меньшими молекулярными массами. Эти процессы широко используются при переработке природного углеводородного сырья.
В отличие от алканов и аренов, углеводороды, молекулы которых содержат двойные и тройные связи (алкены, алкадиены и алкины) легко вступают в реакции присоединения, приводящие к получению алканов (гидрирование), галогенпроизводных (галогенирование, гидрогалогенирование), спиртов (гидратация), полимеров (полимеризация). Ароматические углеводороды также вступают в реакции присоединения, образуя циклоалканы.
Этими свойствами на данном этапе изучения органической химии ограничивается химия углеводородов. Значительно многообразнее химические свойства органических соединений, молекулы которых включают, помимо атомов углерода и водорода, атомы других элементов. Атомы кислорода в составе органических соединений являются составной частью функциональных групп: гидроксильной —ОН, альдегидной —СНО, карбоксильной —СООН. Спирты и фенолы, молекулы которых содержат гидроксильные группы, проявляют слабые кислотные свойства, позволяющие им взаимодействовать со щелочными металлами (спирты) и даже щелочами (фенолы).
Самыми настоящими кислотами являются карбоновые кислоты, молекулы которых содержат карбоксильные группы. Они изменяют окраску индикаторов, реагируют со щелочами, активными металлами, солями, оксидами металлов. Кислоты также вступают в реакцию этерификации со спиртами с образованием сложных эфиров. Представителями сложных эфиров являются жиры, они образованы трёхатомным спиртом глицерином и высшими жирными кислотами, важнейшие из которых — пальмитиновая, стеариновая, олеиновая, линолевая и линоленовая.
Альдегиды, молекулы которых содержат группу —СНО, являются важным классом органических соединений, но на данном этапе изучения органической химии мы ограничились знакомством со способностью альдегидов окисляться до карбоновых кислот (реакция «серебряного зеркала») и восстанавливаться до спиртов. Альдегидную группу содержат молекулы многих углеводов, в частности глюкозы. Углеводы — бифункциональные органические соединения, их молекулы включают, наряду с альдегидной, гидроксильные группы. Глюкоза является пятиатомным альдегидоспиртом и проявляет химические свойства, присущие многоатомным спиртам и альдегидам. На этом примере видно, что знание строения молекул органических соединений позволяет объяснять и даже предсказывать их свойства, что делает возможным целенаправленный синтез веществ.
Молекулы простейших углеводов (моносахаридов) легко подвергаются внутримолекулярной циклизации. Циклы, в свою очередь, за счёт межмолекулярной дегидратации образуют молекулы дисахаридов (мальтоза, сахароза) и макромолекулы полисахаридов (целлюлоза, крахмал).
Изучая кислородсодержащие органические соединения, мы увидели среди них вещества, входящие в состав живых организмов. Это карбоновые кислоты, жиры и углеводы, являющиеся основой растительного и животного мира. Расширило рамки знакомства с «химией живого» изучение азотсодержащих органических соединений, которое привело нас к белкам — веществам, из которых построены объекты животного мира, в том числе мы сами. Мы увидели, что атом азота в составе аминогруппы придаёт веществам оснóвные свойства. Аминокислоты — органические амфотерные соединения, молекулы которых содержат оснóвную —NH2 и кислотную —СООН группы. Межмолекулярная дегидратация аминокислот приводит к пептидам, которыми являются белки.
Знание основ органической химии позволило нам разобраться с основами химии высокомолекулярных соединений, которые образуются в результате реакций полимеризации и поликонденсации органических веществ.
Краткий обзор изученного материала показывает, что органическая химия занимает особое место не только среди химических, но и среди всех естественных наук. Она позволяет нам судить о строении и свойствах веществ, из которых состоит окружающий мир живой природы, а также понять значение достижений химической науки для удовлетворения потребностей современного общества в веществах, без которых оно просто не сможет существовать.
Познакомиться на практике с некоторыми синтетическими полимерами, а также с вопросами и заданиями повышенного уровня сложности вы можете, перейдя по ссылкам в QR-кодах.
Ответы
§ 5. 7. 85,04 %.
§ 10. 3. 9 веществ; 5. 24 г.
§ 11. 1. С3Н8; 2. СН4; 3. С6Н14, 5 изомеров; 4. С5Н12, 3 изомера; 5. C2H6O; 6. С6Н14.
§ 14. 4. Бутен-1.
§ 15. 5. а) 5600 г/моль, б) 200; 6. 4 дм3.
§ 16. 4. А — С3Н6, Б — С3Н8; 5. 2,3-диметилбутен-2; 6. C5H10; 7. 235,2 кг.
§ 17. 7. 30 : 1.
§ 18. 5. Бутин-2; 6. 819 дм3.
§ 19. 6. Бензол.
§ 21. 5. Гептан и этилен; 6. 1,78 дм3; 8. в) 80, г) С6Н14, д) 60 кг.
§ 24. 1. 0,584 дм3; 6. 27,6 %; 7. 247 дм3.
§ 25. 6. 1,68 дм3.
§ 28. 4. 32,8 см3.
§ 30. 4. С4Н9СНО; 5. 4,9 кг.
§ 32. 5. 56,6 г/моль.
§ 33. 4. А — бутанол-2, В — бутен-2, Г — бутанол-1.
§ 34. 5. 5,09 кг.
§ 35. 1. CnH2n—1 —COOH.
§ 36. 1. 1,64 г; 2. 41,1 см3; 3. 35,5 см3 раствора кислоты или примерно 3,5 столовых ложек уксуса.
§ 38. 4. 33 г; 5. 23.
§ 39. 2. Триолеат глицерина; 3. Триолеат глицерина.
§ 41. 5. 2,3 г; 6. 35,6 см3.
§ 42. 9. 1,13, меньше; 10. 538 г; 11. 31,4 г.
§ 43. 6. 2500; 7. а) 185 и б) 580 кг; 8. 84 г.
§ 44. 4. 8765; 6. А — целлюлоза, В — глюкоза, С — глюконовая кислота.
§ 45. 4. CnH2n+3N; 7. С3Н9N.
§ 46. 7. С2Н7N; 8. а) С3Н9N, б) метилэтиламин.
§ 47. 5. 4 дипептида; 8. а) С5Н11О2N, б)
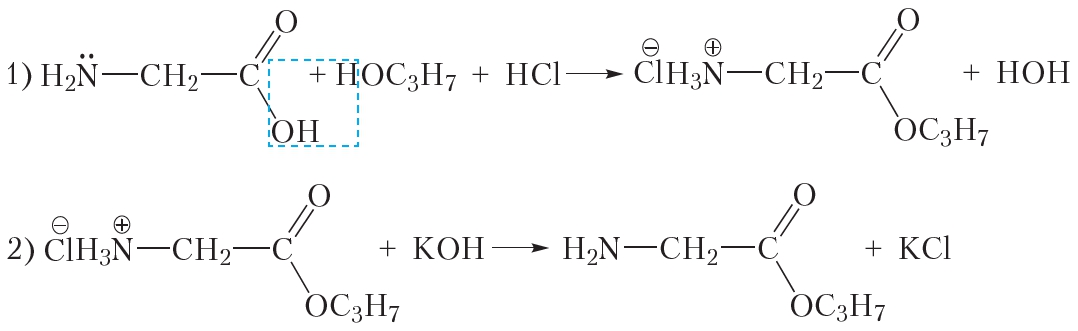
9. С7Н13О4N3.
§ 48. 5. Примерно 5 818 г/моль; 6. Глицилглицин; 7. Аланилаланин.

