§ 48. Белки
| Сайт: | Профильное обучение |
| Курс: | Химия. 10 класс |
| Книга: | § 48. Белки |
| Напечатано:: | Гость |
| Дата: | Sunday, 19 October 2025, 17:44 |
Белки
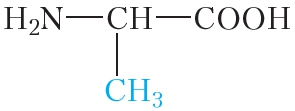
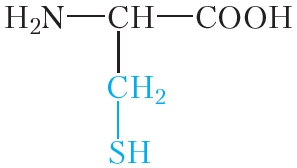
Молекулы белков построены из остатков α-аминокислот:
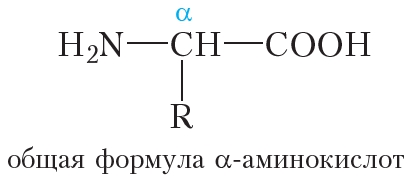
Образование молекулы белка из α-аминокислот можно представить следующей схемой: 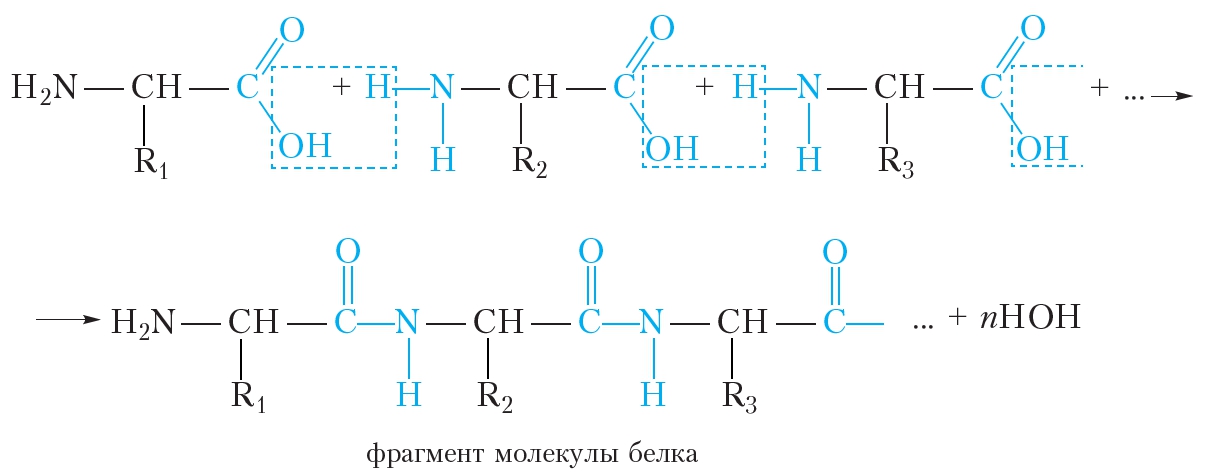
Видно, что в молекулах белков аминокислотные остатки соединены пептидными связями, следовательно, белки являются полипептидами.
Молекулы белков обычно содержат сотни и даже тысячи аминокислотных остатков. При этом наиболее часто в составе белков встречаются остатки 20 разных аминокислот (табл. 48.1).
Таблица 48.1. Некоторые аминокислоты, остатки которых входят в состав белков
|
Формула |
Название |
Обозначение |
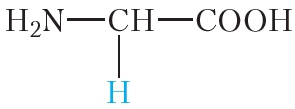 |
глицин | гли |
|
|
аланин |
ала |
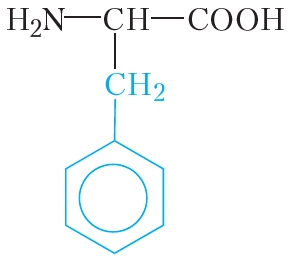 |
фенилаланин | фен |
 |
серин |
сер |
|
|
цистеин |
цис |
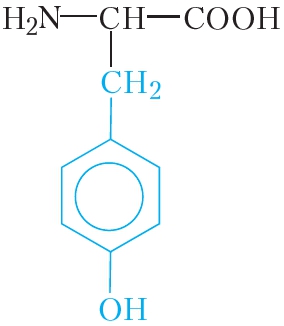 |
тирозин | тир |
Остатки этих аминокислот расположены в макромолекуле белка в строго определённой последовательности (рис. 48.1).
 Из рисунка 48.1 видно, что молекула белка инсулина состоит из двух полипептидных цепей, соединённых двумя дисульфидными мостиками (—S—S—). Каждая полипептидная цепь характеризуется строго определённой последовательностью аминокислотных остатков, причём остатки многих аминокислот встречаются в молекуле инсулина несколько раз. Например, из рисунка 48.1 видно, что остаток глицина (гли) встречается в молекуле инсулина дважды.
Из рисунка 48.1 видно, что молекула белка инсулина состоит из двух полипептидных цепей, соединённых двумя дисульфидными мостиками (—S—S—). Каждая полипептидная цепь характеризуется строго определённой последовательностью аминокислотных остатков, причём остатки многих аминокислот встречаются в молекуле инсулина несколько раз. Например, из рисунка 48.1 видно, что остаток глицина (гли) встречается в молекуле инсулина дважды.
На первый взгляд может показаться, что использование 20 разных аминокислот для построения молекул белков существенно ограничивает разнообразие белковых структур. На самом деле количество комбинаций, которое можно составить, используя для построения полипептидных цепей 20 разных аминокислот, практически бесконечно. Например, если полипептидная цепь будет состоять из 100 аминокислотных остатков, то, используя для её построения 20 различных аминокислот, можно составить 20100 комбинаций!
Свойства белков
Как мы уже убедились, возможно существование огромного множества различных белков. В зависимости от строения аминокислотных остатков и их последовательности в полипептидной цепи свойства белков могут существенно различаться. Например, белок куриного яйца альбумин растворяется в воде, в то же время белки кератины, входящие в состав волос и ногтей, нерастворимы в воде. Рассмотрим некоторые химические свойства белков.
1. Гидролиз
Белки подвергаются гидролизу. При этом происходит постепенное расщепление молекулы белка. Сначала образуются продукты частичного расщепления — пептиды, имеющие молекулярную массу меньшую, чем у исходного белка. Конечными продуктами гидролиза являются α-аминокислоты, из которых построена молекула белка. Рассмотрим реакцию гидролиза на примере трипептида, состоящего из остатков фенилаланина, аланина и глицина:
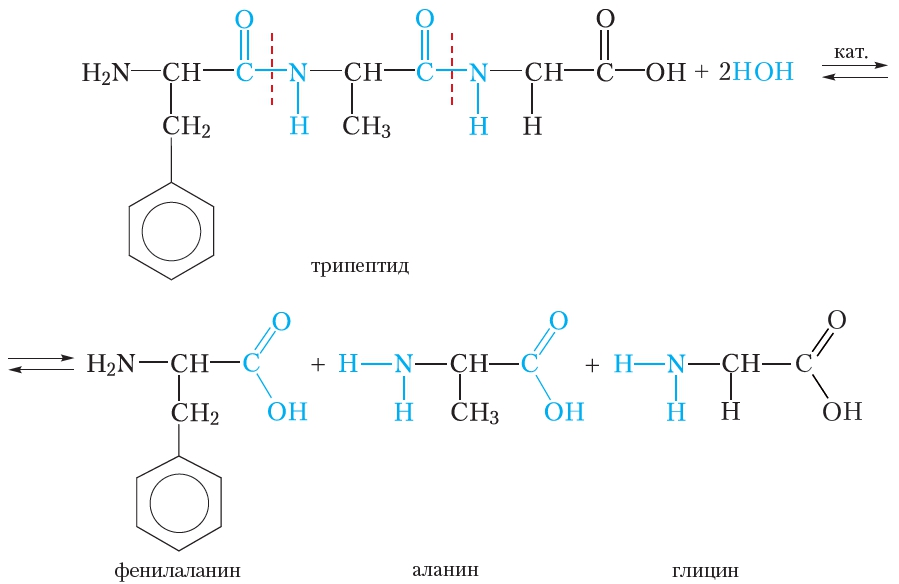
При гидролизе происходит разрыв пептидных связей в молекуле белка. В качестве катализаторов реакции гидролиза белка можно использовать кислоты или щёлочи. В живых организмах гидролиз белков катализируют ферменты.
2. Денатурация
Под действием различных факторов (нагревание, действие кислот, щелочей и др.) может произойти нарушение пространственной структуры молекулы белка (рис. 48.2). Такой процесс называется денатурацией. Например, денатурация белка происходит при варке яиц. В результате денатурации белок утрачивает присущие ему биохимические свойства. 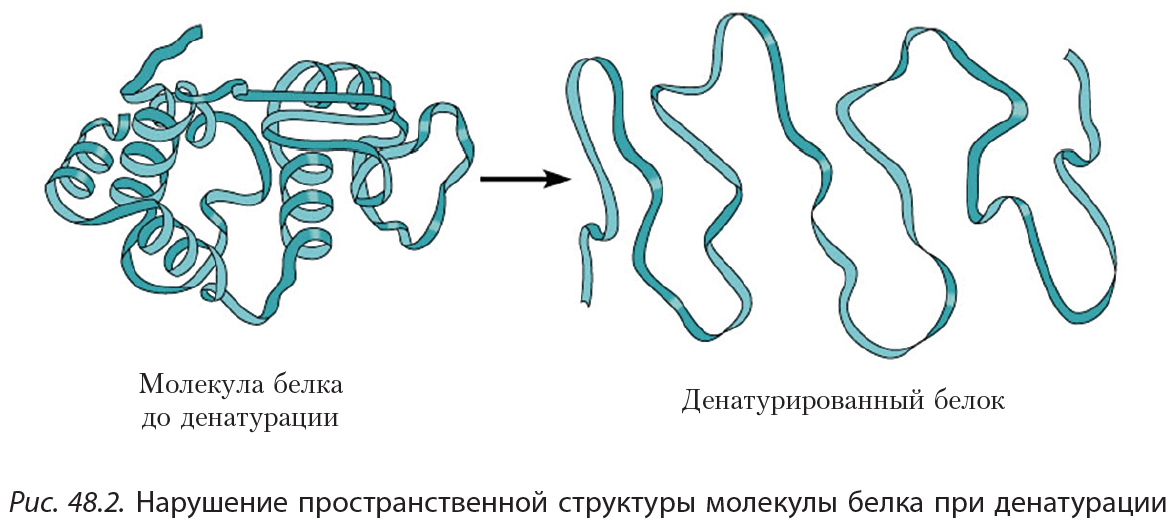
3. Биуретовая реакция (качественная реакция на белки)
реакции белков
Биуретовая реакция является качественной реакцией на белки. Если к водному раствору белка, содержащему немного щёлочи, добавить раствор сульфата меди(II), то образуется сложное комплексное соединение и раствор приобретает красно-фиолетовую окраску. В биуретовую реакцию вступают вещества, содержащие пептидные связи.
4. Ксантопротеиновая реакция
Ксантопротеиновая реакция позволяет обнаружить в белках остатки аминокислот, содержащих бензольное кольцо, например, фенилаланина и тирозина (табл. 48.1). При действии концентрированной азотной кислоты происходит нитрование бензольных колец молекул таких аминокислот:
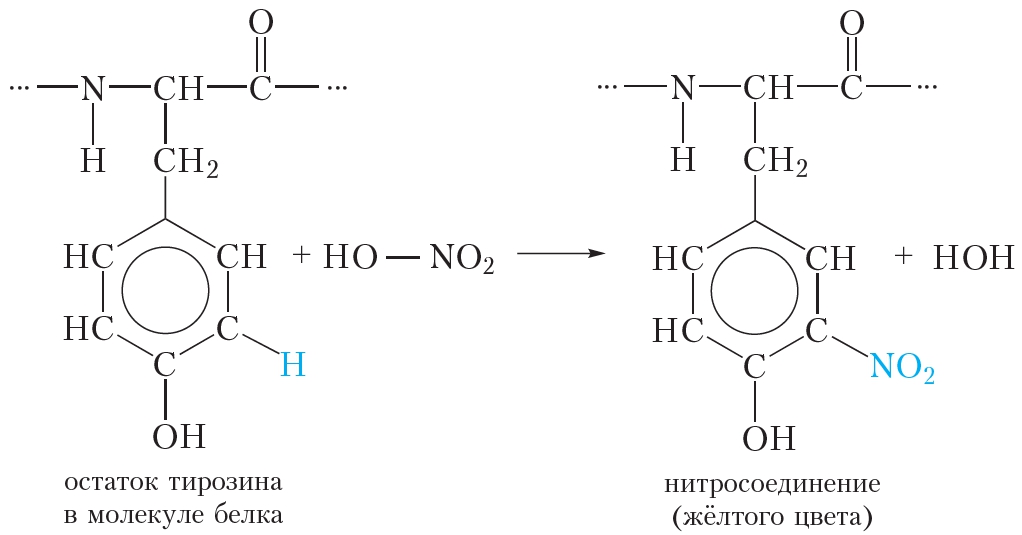
В результате реакции атомы водорода в бензольных кольцах фенилаланина и тирозина замещаются на нитрогруппы —NO2, и появляется жёлтая окраска.
В белках кожи содержится большое число остатков ароматических аминокислот. Поэтому при попадании азотной кислоты на кожу на ней появляются жёлтые пятна.
Белки в живом организме выполняют множество функций. Из белков состоят ткани органов. Катализаторами и регуляторами биохимических процессов выступают ферменты и гормоны — белковые молекулы, каждый вид которых регулирует отдельный процесс. Высокая избирательность фермента обусловлена его уникальным строением.
Белок инсулин выполняет важную роль в обмене веществ — он регулирует углеводный обмен. Недостаточная выработка этого белка поджелудочной железой приводит к тяжелому заболеванию — сахарному диабету.
Белки — важнейший компонент пищи. Если основными источниками энергии для живого организма являются жиры и углеводы, белковый компонент служит в первую очередь источником аминокислот для биосинтеза белков. При этом белки пищи расщепляются на отдельные аминокислоты, из которых затем осуществляется биосинтез. В связи с этим различают заменимые и незаменимые аминокислоты. Заменимые аминокислоты могут быть синтезированы в организме человека из других компонентов пищи, незаменимые не могут быть синтезированы, поэтому обязательно должны поступать в организм с пищей. Примеры заменимых аминокислот — глицин и аланин; незаменимых — фенилаланин и цистеин (табл. 48.1).
В заключение отметим, что, осуществляя знакомство с органической химией, мы прошли путь от простейших органических веществ — углеводородов — к белкам. Дальнейшее изучение органической химии и биологии позволит приоткрыть ещё много тайн живого мира.
|
Молекулы белков построены из остатков α-аминокислот, соединённых пептидными связями. Молекулы белков обычно содержат сотни и даже тысячи аминокислотных остатков. При этом наиболее часто в составе белков встречаются остатки только 20 разных аминокислот. Белки подвергаются гидролизу. Конечными продуктами гидролиза являются α-аминокислоты, из которых построена молекула белка. При нагревании, действии кислот, щелочей и под действием других факторов происходит денатурация белка. В результате денатурации белок утрачивает присущие ему биохимические свойства. Качественной реакцией на белки является биуретовая реакция. Белки, содержащие остатки ароматических аминокислот, дают жёлтое окрашивание с азотной кислотой (ксантопротеиновая реакция). Различают заменимые и незаменимые аминокислоты белков. |
Вопросы и задания
1. Укажите число пептидных связей в молекуле вещества, формула которого:

2. Напишите уравнение реакции гидролиза вещества, формула которого:

3. При полном гидролизе трипептида получена смесь аланина и фенилаланина в мольном соотношении 2 : 1. Составьте все возможные формулы трипептида.
4. При полном гидролизе трипептида получена смесь глицина, аланина и фенилаланина. Составьте все возможные формулы трипептида.
5. В молекуле инсулина человека содержится 6 атомов серы (рис. 48.1). Массовая доля серы в инсулине равна 3,3 %. Оцените молярную массу инсулина.
6. При полном гидролизе 16,5 г дипептида образовалась только одна аминокислота. Её масса равна 18,75 г. Установите строение дипептида.
7. При щелочном гидролизе 16,0 г дипептида образовалось только одно органическое вещество — натриевая соль одной из аминокислот. Масса этой соли равна 22,2 г. Установите строение дипептида.
8*. При полном кислотном гидролизе некоторого пентапептида получены триаминокислоты — глицин, аланин и фенилаланин в мольном отношении 3 : 1 : 1. При частичном гидролизе этого же пентапептида были выделены три трипептида и три дипептида. Определение N-концевых аминокислот в трёх трипептидах показало, что в двух ими является глицин, а в третьей — аланин. Определите последовательность аминокислот в молекуле пентапетида и напишите его структурную формулу.