§ 30. Химические свойства, получение и применение альдегидов
| Сайт: | Профильное обучение |
| Курс: | Химия. 10 класс |
| Книга: | § 30. Химические свойства, получение и применение альдегидов |
| Напечатано:: | Гость |
| Дата: | Tuesday, 21 October 2025, 13:25 |
Химические свойства альдегидов
Химические свойства альдегидов прежде всего обусловлены наличием в их молекулах альдегидной группы. По месту двойной связи альдегидной группы могут протекать реакции присоединения.
1. Гидрирование. Присоединение водорода
Молекула альдегида может присоединить по двойной связи молекулу водорода. Такая реакция сопровождаются разрывом π-связи в молекуле альдегида, так как она менее прочная, чем σ-связь:
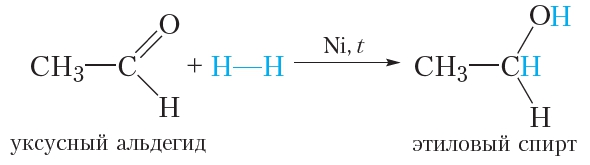
Условия протекания данной реакции схожи с реакцией гидрирования алкенов: смесь водорода с парами альдегида пропускают над нагретым никелевым катализатором.
Продуктом присоединения водорода к альдегиду является первичный спирт.
В результате присоединения водорода молекула альдегида восстанавливается, поэтому реакцию с водородом также называют реакцией восстановления альдегидов.
2. Окисление
Альдегидная группа легко окисляется. В качестве окислителей могут выступать ионы металлов, расположенных в ряду активности правее водорода — ионы серебра (Ag+) и меди (Cu2+).
Окисление альдегидов аммиачным раствором оксида серебра
Если к разбавленному раствору нитрата серебра приливать раствор аммиака, то выпадает белый осадок оксида серебра:
![]()
Реакция "серебряного
зеркала"
Этот осадок сразу же растворяется в избытке аммиака. Образующийся прозрачный раствор называется аммиачным раствором оксида серебра. Если к этому раствору прибавить раствор уксусного альдегида и смесь осторожно нагреть, то вскоре на стенках пробирки образуется блестящий зеркальный налёт серебра, благодаря чему эта реакция называется реакцией «серебряного зеркала».
В протекающей реакции уксусный альдегид окисляется до уксусной кислоты, а оксид серебра восстанавливается с образованием металлического серебра:
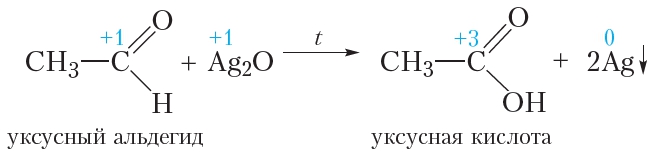
Реакция «серебряного зеркала» является качественной реакцией на альдегиды.
Окисление альдегидов гидроксидом меди(II)
В качестве окислителя альдегидов до соответствующих кислот может быть использован также гидроксид меди(II). Для проведения такой реакции в пробирку помещают раствор сульфата меди(II), затем прибавляют раствор щёлочи. При этом выпадает голубой осадок гидроксида меди(II):
![]()
Затем в пробирку с осадком добавляют водный раствор альдегида и смесь нагревают. В процессе нагревания изначально голубой осадок становится жёлтым, а при дальнейшем нагревании — красным. Уравнение протекающей реакции: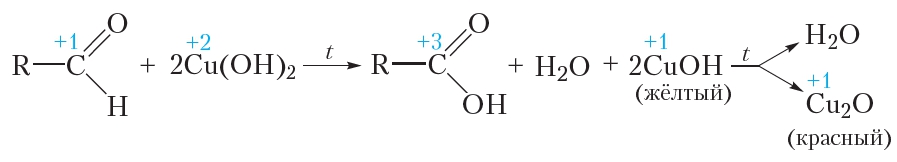
Как видно из приведённого уравнения реакции, в результате восстановления гидроксида меди(II) образуется жёлтый осадок гидроксида меди(I), который при нагревании разлагается с образованием красного оксида меди(I).
Как и в случае реакции «серебряного зеркала», продуктом окисления альдегида является карбоновая кислота.
Реакция окисления альдегидов гидроксидом меди(II) так же, как и реакция «серебряного зеркала», является качественной реакцией на альдегиды.
Способность альдегидов окисляться до карбоновых кислот и восстанавливаться до спиртов особенно наглядно демонстрирует взаимосвязь между классами органических соединений, благодаря которой вещества одного класса могут быть получены из представителей других классов.
Получение альдегидов
1. Неполное окисление спиртов
Как вы уже знаете, альдегиды могут быть получены при неполном окислении первичных спиртов оксидом меди(II) (§ 24). Так, при окислении этилового спирта образуется уксусный альдегид: 
Для проведения реакции медную проволоку прокаливают в пламени спиртовки, в результате поверхность проволоки покрывается чёрным оксидом меди(II). Затем проволоку погружают в этиловый спирт, при этом оксид меди(II) окисляет спирт до уксусного альдегида и образуется медь, поэтому проволока снова становится блестящей (видео 24.1).
2. Гидратация ацетилена
Уксусный альдегид можно получить по реакции присоединения воды к ацетилену в присутствии солей ртути и серной кислоты: Эта реакция носит имя русского химика Михаила Григорьевича Кучерова.
Эта реакция носит имя русского химика Михаила Григорьевича Кучерова.

Напомним, что радикал CH2 ![]() CH
CH ![]() имеет тривиальное называние винил. Спирты, у которых гидроксильная группа находится при двойной связи C
имеет тривиальное называние винил. Спирты, у которых гидроксильная группа находится при двойной связи C ![]() C, неустойчивы, поэтому виниловый спирт сразу же превращается в уксусный альдегид:
C, неустойчивы, поэтому виниловый спирт сразу же превращается в уксусный альдегид: 
 С промышленным методом получения уксусного альдегида вы можете познакомиться, перейдя по ссылке в QR-коде.
С промышленным методом получения уксусного альдегида вы можете познакомиться, перейдя по ссылке в QR-коде.
Применение
Наибольшее применение имеют муравьиный и уксусный альдегиды.
Некоторые области использования муравьиного альдегида основаны на его свойстве свёртывать белки. Он используется в медицине в качестве консерванта биологических тканей. Формальдегид широко применяется в кожевенном производстве, так как, оказывая влияние на белки кожи, он делает последнюю более твёрдой и устойчивой к гниению.
В результате взаимодействия формальдегида с аммиаком получают лекарственное средство — уротропин.
Кроме того формальдегид используется в производстве фенолформальдегидных пластмасс. Основу таких пластмасс составляет высокомолекулярное соединение — фенолформальдегидная смола. Она образуется при нагревании фенола с формальдегидом в присутствии катализатора. Механизм образования фенолформальдегидной смолы достаточно сложен и представлен схематически:

Как видно из приведённой схемы, в результате реакции образуется линейный полимер, в котором молекулы фенола соединены группами —CH2— через положения 2 и 6 бензольного кольца. Кроме этого, некоторые остатки фенола содержат в положении 4 бензольного кольца группы —CH2OH.
За счёт групп —CH2OH при нагревании до 130—150 °С такой полимер «сшивается», образуя очень твёрдую и прочную фенолформальдегидную смолу с «сетчатой» структурой: 
Материалы на основе фенолформальдегидных смол обычно изготавливают, смешивая расплавленный полимер линейного строения с наполнителем (древесная мука, стружки, асбест и др.). Далее полученный материал прессуют при нагревании. При этом расплавленный полимер хорошо заполняет форму, а затем затвердевает, образуя «сетчатую» структуру. В результате получается монолитное твёрдое изделие. Некоторые материалы, в которых фенолформальдегидная смола выступает в качестве связующего, вам хорошо знакомы. Например, некоторые виды ДСП (древесностружечная плита) представляют собой смесь древесных стружек, скреплённых между собой фенолформальдегидным полимером.
В процессе образования фенолформальдегидной смолы из низкомолекулярных веществ — фенола и формальдегида — в результате отщепления воды образуется высокомолекулярное вещество. Такой процесс называется поликонденсацией. Следует различать процессы поликонденсации и полимеризации. В процессе поликонденсации наряду с высокомолекулярным соединением образуется побочный низкомолекулярный продукт. В рассмотренной реакции поликонденсации фенола с формальдегидом этим продуктом является вода.
В процессе полимеризации высокомолекулярное вещество (полимер) образуется в результате многократно повторяющейся реакции присоединения. Поэтому, в отличие от поликонденсации, процесс полимеризации не сопровождается образованием побочных низкомолекулярных продуктов.
Уксусный альдегид в больших количествах используется для производства уксусной кислоты, а также других органических веществ.
|
Альдегиды вступают в реакции присоединения по месту двойной связи C Альдегиды окисляются гидроксидом меди(II) и аммиачным раствором оксида серебра до карбоновых кислот. Эти реакции являются качественными реакциями на альдегидную группу. Альдегиды могут быть получены окислением первичных спиртов оксидом меди(II). Уксусный альдегид можно получить присоединением воды к ацетилену в присутствии солей ртути и серной кислоты. Альдегиды используются для получения пластмасс, лекарственных препаратов, для синтеза органических веществ, а также в парфюмерии. |
*Получение уксусного альдегида
В настоящее время уксусный альдегид получают в результате так называемого Вакер-процесса. Для этого газообразную смесь этилена с кислородом пропускают через водный раствор, содержащий хлориды палладия(II) и меди(II). Происходящие процессы можно выразить суммарным уравнением:

Вопросы и задания
1. Какие спирты образуются в результате восстановления водородом этаналя и 2-метилпропаналя? Напишите уравнения реакций, назовите образующиеся продукты.
2. Напишите уравнение реакции пропаналя с гидроксидом меди(II) при нагревании. Опишите наблюдаемые явления.
3. В результате нагревания водного раствора вещества А с аммиачным раствором оксида серебра образуется кислота Б, а стенки пробирки покрываются серебряным налётом.
При пропускании смеси вещества А с водородом над нагретым никелевым катализатором образуется спирт В. При нагревании спирта В с концентрированной серной кислотой получается углеводород Г, немного легче воздуха. Установите формулы веществ А—Г и приведите уравнения реакций, описанных в задании.
4. В результате окисления 2,15 г гомолога уксусного альдегида аммиачным раствором Ag2O было получено 5,4 г серебра. Установите молекулярную формулу альдегида.
5. Одним из современных промышленных методов получения уксусного альдегида является окисление этилена хлоридом палладия в присутствии хлорида меди(II) и кислорода воздуха (Вакер-процесс):
![]()
Для синтеза этаналя в промышленных условиях смесь этилена и кислорода пропускают через реактор, содержащий раствор хлоридов палладия и меди(II) при температуре 130 оС и давлении 400 кПа. Известно, что степень превращения веществ в реакторе в указанных условиях составляет 25 %. Укажите массу этаналя, образующегося из этилена объёмом (н. у.) 10 м3 и достаточного количества кислорода.
6*. При действии воды на твёрдое вещество А образуется газ (н. у.) Б, легче воздуха. При пропускании Б через горячий водный раствор содержащий серную кислоту и сульфат ртути(II) образуется органическое вещество В. Вещество В можно также получить двухстадийным синтезом. Сначала вещество Б гидрируют на специальных катализаторах. При этом образуется газ (н. у.) Г, легче воздуха. Затем смесь газа Г и кислорода поглощают водным раствором, содержащим смесь CuCl2 и PdCl2. При этом образуется вещество В.
а) Приведите структурные формулы веществ А, Б, В и Г.
б) Напишите уравнения всех описанных в задаче реакций.
в) При гидрировании вещества В образуется вещество Д, имеющее только один изомер (вещество Е). Приведите формулы и названия веществ Д и Е, а также уравнение реакции гидрирования вещества В.
г) Температура кипения какого вещества (Д или Е) выше и почему?
7*. Напишите схемы реакций, с помощью которых можно получить в две стадии бромэтан, исходя из уксусного альдегида.
