§ 25. Многоатомные спирты
| Сайт: | Профильное обучение |
| Курс: | Химия. 10 класс |
| Книга: | § 25. Многоатомные спирты |
| Напечатано:: | Гость |
| Дата: | Sunday, 31 August 2025, 04:30 |
Многоатомные спирты
В молекулах многоатомных спиртов, в отличие от одноатомных, содержится не одна, а несколько гидроксильных групп. Приведём формулы простейших двухатомного и трёхатомного спиртов: 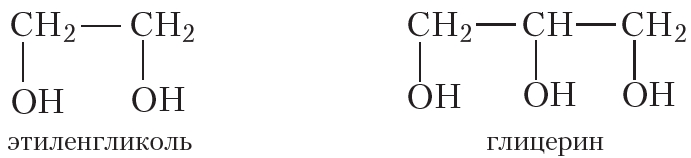
Обратите внимание, что в молекулах многоатомных спиртов гидроксильные группы находятся у разных атомов углерода. Вещества, в которых две гидроксильные группы соединены с одним и тем же атомом углерода, неустойчивы и не могут быть получены в свободном виде. Такие вещества сразу же отщепляют молекулу воды: 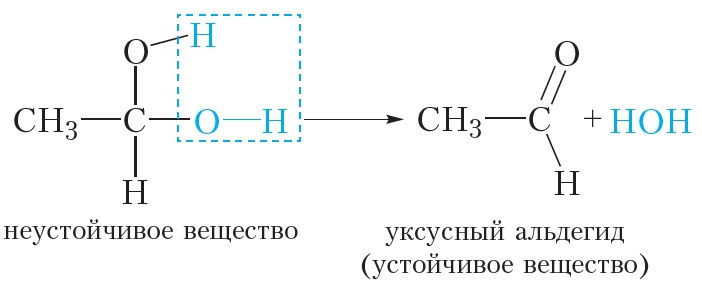
В связи с этим молекула двухатомного спирта должна содержать не менее двух атомов углерода, трёхатомного — трёх и т. д.
Простейший двухатомный спирт называется этиленгликоль, трёхатомный — глицерин. Эти вещества похожи друг на друга по физическим свойствам и представляют собой бесцветные вязкие жидкости. Между молекулами многоатомных спиртов, как и между молекулами одноатомных спиртов, образуются водородные связи, поэтому этиленгликоль и глицерин имеют высокие температуры кипения: 198 °С и 290 °С соответственно. Полярные гидроксильные группы придают многоатомным спиртам растворимость в воде. Этиленгликоль и глицерин смешиваются с водой в любых соотношениях.
Названия многоатомных спиртов строят так же, как и названия одноатомных. Наличие в молекуле двух гидроксильных групп обозначается сочетанием -диол, трёх -триол и т. д. Назовём этиленгликоль и глицерин по номенклатуре ИЮПАК:
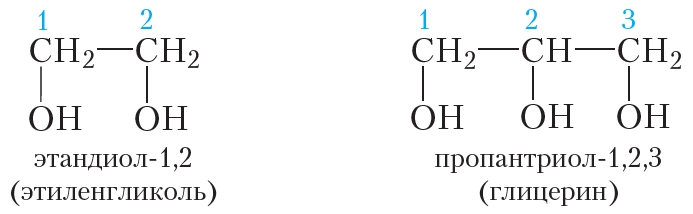
Состав молекул этиленгликоля и глицерина различается на группу CH—OH, а не СН2: 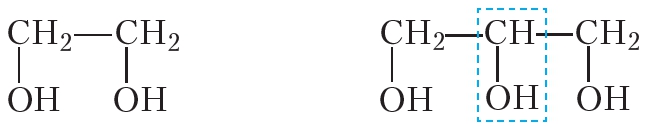
То есть этиленгликоль и глицерин не являются гомологами. Ближайшим гомологом этиленгликоля является пропандиол-1,2:
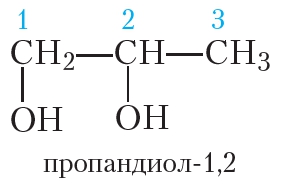
Ближайший гомолог глицерина — бутантриол-1,2,3: 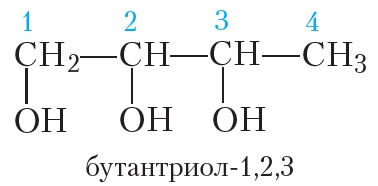
Химические свойства многоатомных спиртов
Молекулы многоатомных спиртов содержат гидроксильные группы. Поэтому многоатомные спирты могут вступать в те же химические реакции, что и одноатомные спирты.
1. Взаимодействие со щелочными металлами
Так же, как и одноатомные, многоатомные спирты реагируют со щелочными металлами. В ходе реакции атомы водорода гидроксильных групп замещаются на атомы металла:

2. Взаимодействие с галогеноводородами
При взаимодействии с галогеноводорородами гидроксильные группы в молекулах многоатомных спиртов замещаются на атомы галогена. Приведём уравнение реакции этиленгликоля с бромоводородом:

Замещение второй гидроксильной группы протекает труднее, чем первой.
При взаимодействии многоатомных спиртов с азотной кислотой в молекулу спирта вместо атомов водорода гидроксильных групп вводятся группы —NO2. Реакция протекает в присутствии концентрированной серной кислоты, которая является катализатором. Приведём уравнение реакции глицерина с азотной кислотой:

Продукт реакции — нитроглицерин — бесцветная маслянистая жидкость. Он легко взрывается (склонен к детонации), поэтому в чистом виде не используется. Нитроглицерин является сосудорасширяющим средством, поэтому он входит в состав лекарственных препаратов.
Со щелочными металлами, галогеноводородами и азотной кислотой реагируют не только многоатомные, но и одноатомные спирты. В то же время многоатомные спирты могут вступать в реакции, которые не протекают в случае одноатомных спиртов. Такой реакцией является взаимодействие многоатомных спиртов с гидроксидом меди(II).
4. Взаимодействие с гидроксидом меди(II)
Для проведения этой реакции в пробирку наливают раствор щёлочи, затем немного раствора сульфата меди(II). При этом выпадает голубой осадок гидроксида меди(II):
![]()
Затем в пробирку с осадком добавляют водный раствор этиленгликоля. При этом гидроксид меди(II) растворяется и образуется прозрачный раствор васильково-синего цвета. Растворение гидроксида меди(II) при взаимодействии с этиленгликолем происходит вследствие образования комплексного соединения:

Качественная реакция
на многоатомные спирты
Аналогично в реакцию с гидроксидом меди(II) вступает глицерин. С помощью этой реакции легко отличить водные растворы многоатомных спиртов от растворов других органических веществ, поэтому взаимодействие с гидроксидом меди(II) является качественной реакцией на многоатомные спирты.
Применение этиленгликоля и глицерина
Несмотря на внешнее сходство и подобие химических свойств, физиологическое действие этиленгликоля и глицерина совершенно разное. Этиленгликоль ядовит, тогда как глицерин нетоксичен и даже используется в качестве пищевой добавки (Е422).
Водные растворы этиленгликоля имеют очень низкую температуру замерзания (до –70 °C). Благодаря этому этиленгликоль применяется в качестве компонента незамерзающих жидкостей — антифризов, использующихся в системах охлаждения автомобильных двигателей.
Глицерин хорошо поглощает влагу (обладает свойством гигроскопичности). Поэтому он используется в качестве увлажняющего компонента при производстве различных мазей, кремов и других косметических средств. Так же, как и этиленгликоль, глицерин применяется в производстве антифризов.
Кроме того, этиленгликоль и глицерин используются в химической промышленности в качестве реагентов для получения других органических веществ.
|
Многоатомные спирты, в отличие от одноатомных, содержат в молекуле несколько гидроксильных групп. Простейший двухатомный спирт — этиленгликоль, трёхатомный — глицерин. Как и одноатомные спирты, этиленгликоль и глицерин взаимодействуют со щелочными металлами и галогеноводородами. В результате реакции между глицерином и азотной кислотой образуется нитроглицерин. Нитроглицерин является сосудорасширяющим средством, поэтому он входит в состав лекарственных препаратов. Качественной реакцией на многоатомные спирты является образование раствора васильково-синего цвета при взаимодействии со свежеосаждённым гидроксидом меди(II). |
Вопросы и задания
1. Напишите структурные формулы этиленгликоля и глицерина. Являются ли эти вещества гомологами?
2. Почему этиленгликоль и глицерин имеют высокие температуры кипения и хорошо растворяются в воде?
3. Напишите структурную формулу ближайшего гомолога этиленгликоля. Приведите его название по номенклатуре ИЮПАК и напишите уравнение реакции его с натрием.
4. Укажите реактив, который позволяет различить водные растворы этанола и этиленгликоля. Напишите уравнение реакции.
5. Напишите схемы реакций, с помощью которых можно осуществить следующие превращения органических веществ:
![]()
6. К этиленгликолю массой 6,2 г прибавили натрий массой 3,45 г. Найдите объём (н. у.) водорода, выделившийся после полного завершения реакции.
