§ 24. Химические свойства, получение и применение спиртов
| Сайт: | Профильное обучение |
| Курс: | Химия. 10 класс |
| Книга: | § 24. Химические свойства, получение и применение спиртов |
| Напечатано:: | Гость |
| Дата: | Воскресенье, 3 Август 2025, 16:53 |
Химические свойства, получение и применение спиртов
Многие химические свойства спиртов определяются наличием в их молекулах гидроксильной группы, поэтому гидроксильную группу называют функциональной.
Рассмотрим химические свойства насыщенных одноатомных спиртов.
1. Взаимодействие со щелочными металлами
Если в стаканчик с этиловым спиртом поместить кусочек натрия, начнётся бурная реакция, сопровождающаяся выделением водорода:
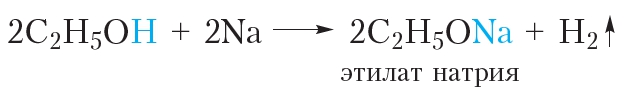
В этой реакции происходит замещение атома водорода гидроксильной группы атомом металла.
Так же реагируют с натрием и другие спирты. Приведём уравнение реакции пропанола-1 с натрием:
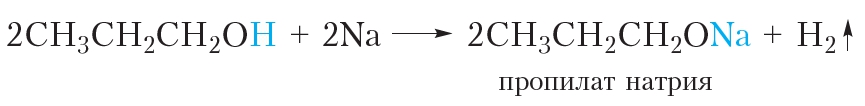
При взаимодействии с активными металлами спирты проявляют кислотные свойства. Кислотные свойства спиртов выражены очень слабо (слабее, чем у воды!), поэтому спирты не изменяют окраску индикаторов, не реагируют со щелочами и могут взаимодействовать только с самыми активными металлами, например со щелочными металлами натрием и калием.
Продукты замещения атома водорода гидроксильной группы спирта атомом металла называются алкоголятами. Приведём названия некоторых алкоголятов:
![]()
Алкоголяты представляют собой твёрдые солеподобные вещества. Они разлагаются водой с образованием спирта и щёлочи:
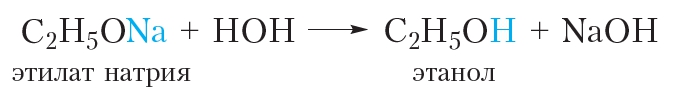
2. Взаимодействие с галогеноводородами
Спирты взаимодействуют с галогеноводородами (HCl, HBr, HI). При этом гидроксильная группа замещается на галоген. Приведём уравнение реакции этилового спирта с бромоводородом: 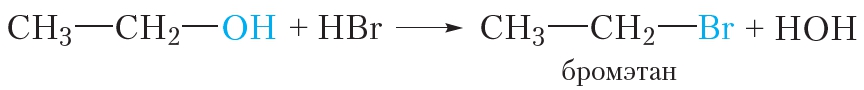
Так же реагируют с галогеноводородами и другие спирты. Например, при взаимодействии пропанола-2 с хлороводородом происходит замещение гидроксильной группы и образуется 2-хлорпропан: 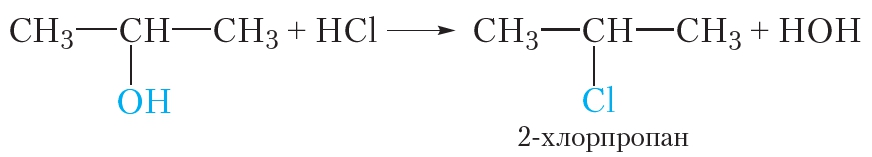
3. Дегидратация. Отщепление воды
При нагревании с сильными водоотнимающими средствами, такими как концентрированная серная кислота, от спиртов отщепляется молекула воды. Реакция отщепления молекулы воды называется реакцией дегидратации (§ 16).
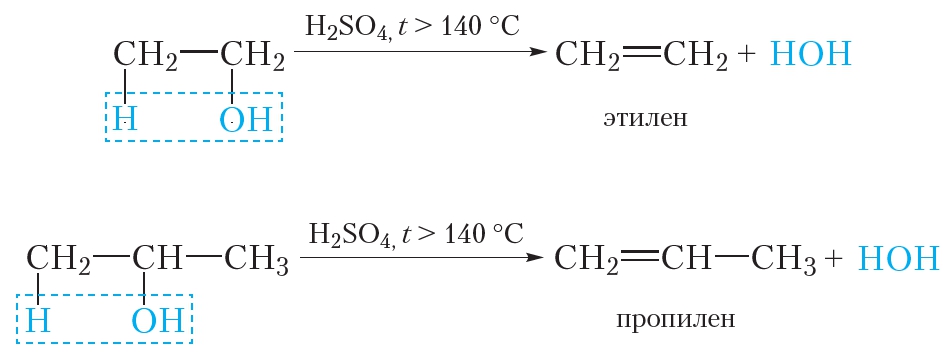
В данных реакциях от одной молекулы спирта отщепляется одна молекула воды. Такая реакция называется внутримолекулярной дегидратацией. В результате внутримолекулярной дегидратации спиртов образуются алкены.
При менее сильном нагревании одна молекула воды может отщепляться от двух молекул спирта: 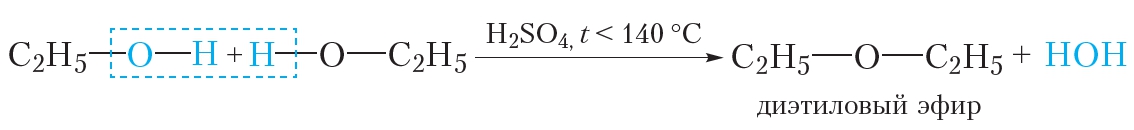
Эта реакция называется межмолекулярной дегидратацией.
В результате межмолекулярной дегидратации спиртов образуются простые эфиры. Строение простых эфиров можно выразить следующей формулой: R—O—R'. Углеводородные радикалы в молекуле простого эфира могут быть одинаковыми или различными. Простые эфиры изомерны спиртам (§ 22).
Продукт реакции межмолекулярной дегидратации этилового спирта — диэтиловый эфир — представляет собой бесцветную жидкость со специфическим запахом и низкой температурой кипения (tкип = 35 °С). Он используется в медицинской практике для наркоза и дезинфекции кожи при проведении инъекций.
Приведём уравнение реакции межмолекулярной дегидратации метанола:
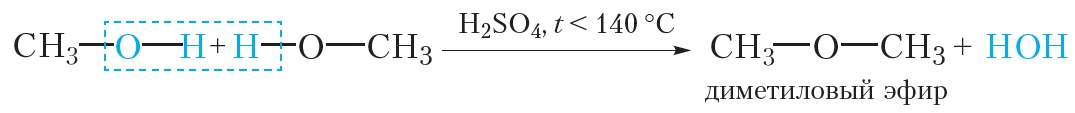
При этом образуется диметиловый эфир — газообразное при нормальных условиях вещество с температурой кипения –25 °С.
Обратите внимание, что температуры кипения простых эфиров намного ниже, чем изомерных спиртов. На рисунке 24.1 изображены шаростержневые модели молекул этанола и диметилового эфира и указаны их температуры кипения.
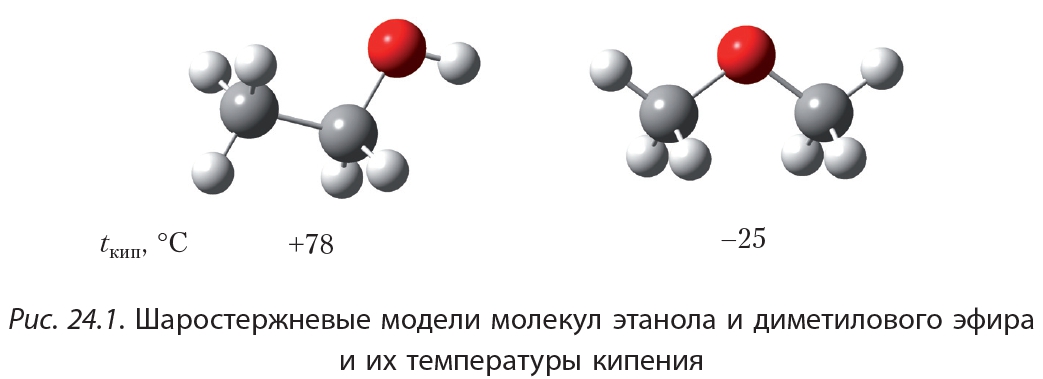
Этанол и диметиловый эфир являются изомерами, их молекулы имеют примерно одинаковые размеры, поэтому, казалось бы, температуры кипения должны быть близки. Тем не менее, температура кипения этанола более чем на 100° С выше температуры кипения диметилового эфира. Напомним, что высокие температуры кипения спиртов объясняются образованием водородных связей между их молекулами. Водородная связь образуется между атомом водорода гидроксильной группы одной молекулы спирта и атомом кислорода другой молекулы. Между молекулами простых эфиров водородные связи не образуются, так как в молекулах простых эфиров нет гидроксильных групп.
4. Окисление
Спирты горят при поджигании, в этом мы можем убедиться, зажигая спиртовку:
![]()
В результате образуются углекислый газ и вода. Такая реакция называется полным окислением.
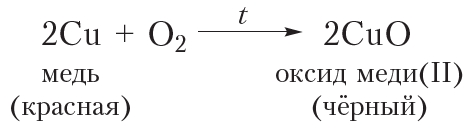
После этого раскалённую проволоку быстро поместим в стакан с небольшим количеством этилового спирта. Проволока при этом опять становится блестящей (видео 24.1). Это свидетельствует о том, что из чёрного оксида меди(II) образовалась медь. То есть произошло восстановление оксида меди(II). Восстановителем является этиловый спирт. В ходе реакции он окисляется до уксусного альдегида: 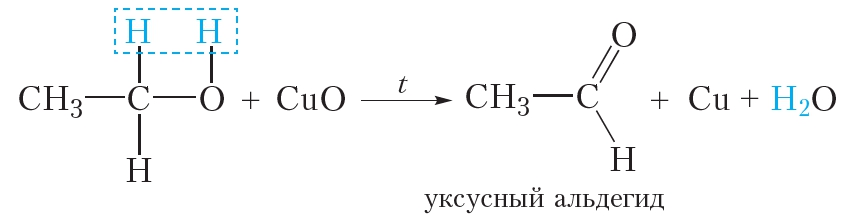
Получение и применение спиртов
Некоторые реакции, в результате которых образуются спирты, вы уже знаете (§ 15).
1. Гидратация алкенов
Спирты образуются в результате присоединения воды к алкенам. Эта реакция называется реакцией гидратации:
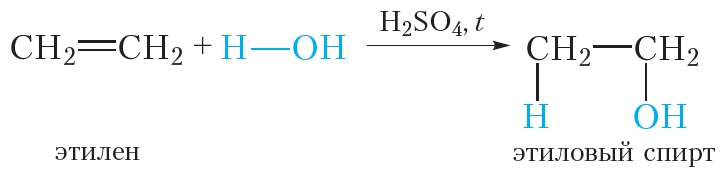
2. Взаимодействие галогеналканов с водным раствором щёлочи
Спирты можно получить из галогеналканов, действуя на них водным раствором щёлочи:
![]()
В результате реакции атом галогена замещается на гидроксильную группу. В свою очередь, галогенпроизводные алканов могут быть получены из углеводородов. Например, хлорэтан образуется при взаимодействии этана с хлором: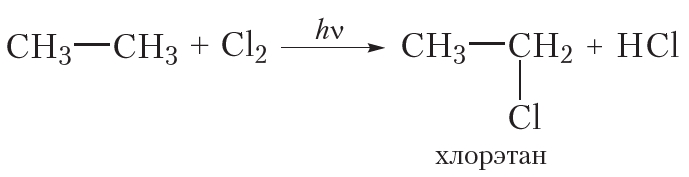
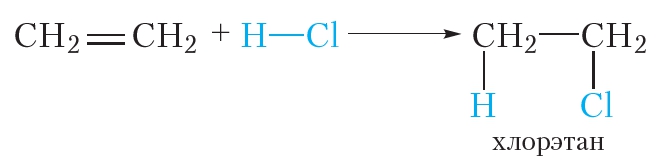
Хлорэтан можно получить также из этилена путём присоединения к нему хлороводорода:
получение метанола
Таким образом, можно синтезировать спирты, используя в качестве исходных веществ углеводороды.
Метанол и этанол применяются в качестве растворителей. Кроме того, они используются в химической промышленности в качестве реагентов для получения многих органических веществ. Этанол используется в пищевой промышленности.
|
Спирты реагируют со щелочными металлами, при этом атом водорода гидроксильной группы замещается атомом металла. Спирты взаимодействуют с галогеноводородами, при этом гидроксильная группа замещается на галоген. Спирты вступают в реакции внутримолекулярной и межмолекулярной дегидратации с образованием алкенов и простых эфиров. Спирты вступают в реакции окисления. При полном окислении спиртов образуются углекислый газ и вода. Неполным окислением первичным спиртов могут быть получены альдегиды. Спирты получают взаимодействием галогеналканов с водным раствором щёлочи и присоединением воды к алкенам. |
*Окисление спиртов
При окислении первичных спиртов образуются альдегиды. Приведём схему реакции окисления этанола:
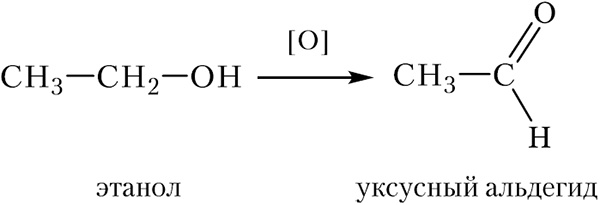
В органической химии в схемах процессов окисления часто используют символ кислорода в квадратных скобках [O]. Окислителями при этом могут быть различные вещества, в случае окисления спиртов это, как правило, хромовая смесь (смесь дихромата калия K2Cr2O7 и концентрированной серной кислоты).
При окислении вторичных спиртов образуются кетоны, так, продуктом окисления пропанола-2 является ацетон:
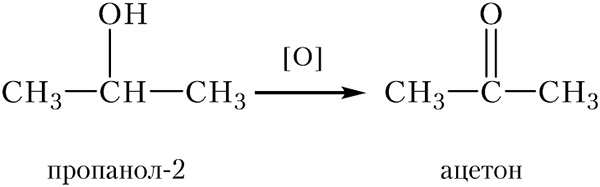
Окисление третичных спиртов протекает в жёстких условиях. При этом разрушается углеродный скелет молекулы.
*Получение метанола в промышленности
Метанол, в отличие от этанола, нельзя получить гидратацией алкена. Раньше метанол получали нагреванием древесины без доступа воздуха, так называемой сухой перегонкой древесины, отсюда его тривиальное название — древесный спирт. Современный метод промышленного получения метанола — взаимодействие оксида углерода(II) с водородом. Реакцию проводят при высоком давлении (10 МПа) и температуре 250 °С в присутствии катализаторов на основе оксидов цинка и меди:
![]()
Напомним, что смесь оксида углерода(II) с водородом называется синтез-газ.
Вопросы и задания
1. Напишите уравнение реакции пропанола-2 с натрием. Какой объём (н. у.) водорода выделится при растворении 1,2 г натрия в избытке пропанола-2?
2. Напишите уравнения реакций: а) этанола с иодоводородом; б) пропанола-2 с бромоводородом; в) 2-метилпропанола-2 с хлороводородом. Назовите образующиеся галогенпроизводные по номенклатуре ИЮПАК.
3. Напишите уравнения реакций, при помощи которых можно получить метанол из метана.
4. Предложите два способа получения этанола из этана.
5. Даны реагенты: натрий, бромоводород, гидроксид калия, бромная вода. С какими из перечисленных веществ реагирует этанол? Напишите уравнения реакций.
5. Этиловый спирт объёмом 50 см3 смешали с концентрированной серной кислотой и нагрели до 150 оС. При этом выделился этилен объёмом 5,3 дм3 (н. у.). Рассчитайте, какая часть (%) этанола подверглась внутримолекулярной дегидратации. Плотность этанола 0,79 г/см3.
6. Какой объём этанола можно получить гидратацией 100 м3 (н. у.) этилена, если выход продукта реакции составляет 95 %? Плотность этанола 0,79 г/см3.
7*. Напишите схемы реакций, с помощью которых можно получить из этанола: а) бромэтан; б) ацетилен; в) бензол; г) этиленгликоль.