§ 15. Физические и химические свойства алкенов
| Сайт: | Профильное обучение |
| Курс: | Химия. 10 класс |
| Книга: | § 15. Физические и химические свойства алкенов |
| Напечатано:: | Гость |
| Дата: | Saturday, 25 October 2025, 15:10 |
Физические свойства
По физическим свойствам алкены мало отличаются от алканов с тем же числом атомов углерода в молекуле. Так, алкены с числом атомов углерода в молекуле 2—4 при комнатной температуре являются бесцветными газами. Алкены с числом атомов углерода в молекуле от 5 до 17 — жидкости. Алкены с ещё бóльшим числом атомов углерода в молекуле (от 18 и более) представляют собой твёрдые вещества. Температуры кипения некоторых алкенов неразветвлённого строения приведены в таблице 15.1.
Таблица 15.1. Температуры кипения алкенов
|
Название |
Структурная формула |
Температура кипения (tкип, °С) |
|
Этен |
|
–104 |
|
Пропен |
|
–48 |
|
Бутен-1 |
|
–6 |
|
Пентен-1 |
|
30 |
|
Гексен-1 |
|
64 |
|
Гептен-1 |
|
93 |
|
Октен-1 |
|
122 |
Так же, как и алканы, алкены нерастворимы в воде, но хорошо растворяются в органических растворителях.
Плотность алкенов меньше, чем у воды.
Химические свойства
Благодаря наличию в молекуле π-связи реакционная способность алкенов намного выше, чем у алканов. Напомним, что для алканов характерны реакции замещения. Для алкенов характерными являются реакции присоединения:
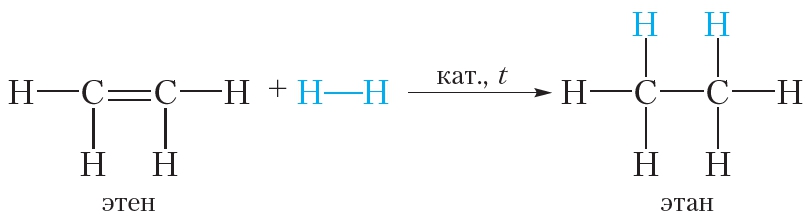
Эти реакции сопровождаются разрывом π-связи, так как она менее прочная, чем σ-связь.
В реакции присоединения алкены вступают в более мягких условиях, чем алканы в реакции замещения. Реакции замещения для алкенов нехарактерны.
Реакции присоединения
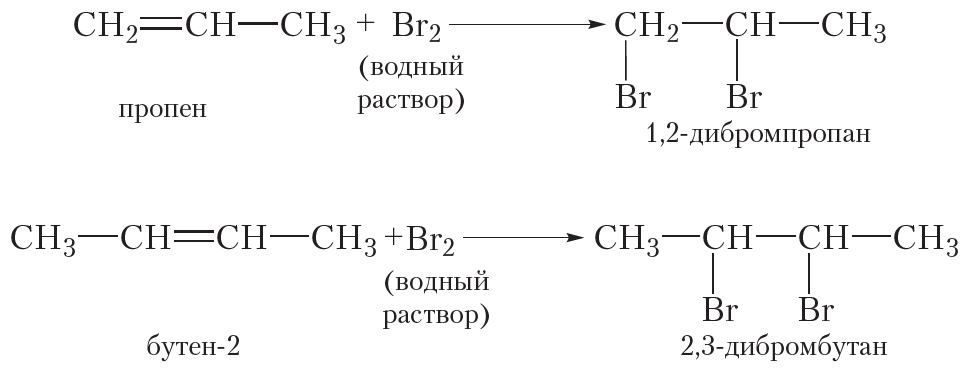
1. Галогенирование. Присоединение галогенов
Алкены так же, как и алканы, взаимодействуют с галогенами. Однако в случае алкенов происходит реакция присоединения, а не замещения. Сравним эти реакции.
Бромирование этилена (реакция присоединения):
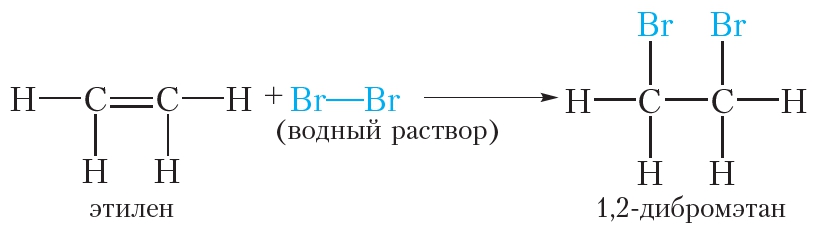
Бромирование этана (реакция замещения):
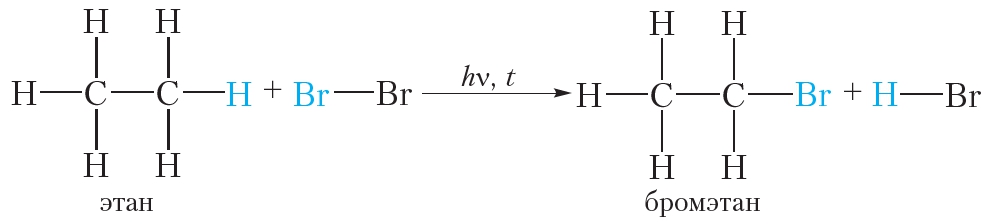
Этилен реагирует с водным раствором брома (бромной водой) при обычных условиях, в то время как реакция этана с бромом возможна только в жёстких условиях — при нагревании или ультрафиолетовом облучении.
При пропускании этилена через бромную воду протекает реакция присоединения брома по двойной связи. В результате оранжевый раствор брома обесцвечивается.
В молекуле этана нет двойных связей, поэтому при пропускании этана через бромную воду химическая реакция не протекает и раствор брома остаётся оранжевым.
Следовательно, реакция с бромной водой является качественной реакцией на двойную связь.
Подобно этилену, другие алкены легко присоединяют бром, обесцвечивая бромную воду:
2. Гидрирование. Присоединение водорода
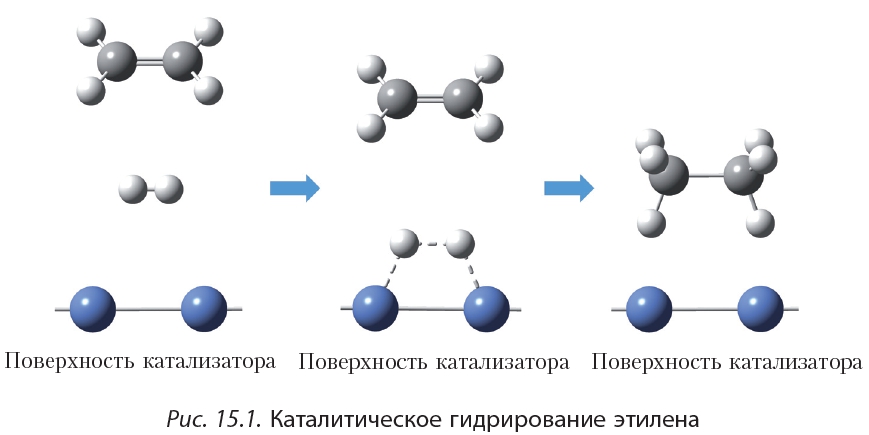
Присоединение водорода к органическому веществу называется реакцией гидрирования. При обычных условиях алкены не присоединяют водород. Для протекания реакции необходим катализатор (Pt или Ni).
В результате гидрирования алкенов образуются алканы. В начале данного параграфа приведено уравнение реакции гидрирования этена. Приведём уравнения реакций гидрирования некоторых других алкенов:
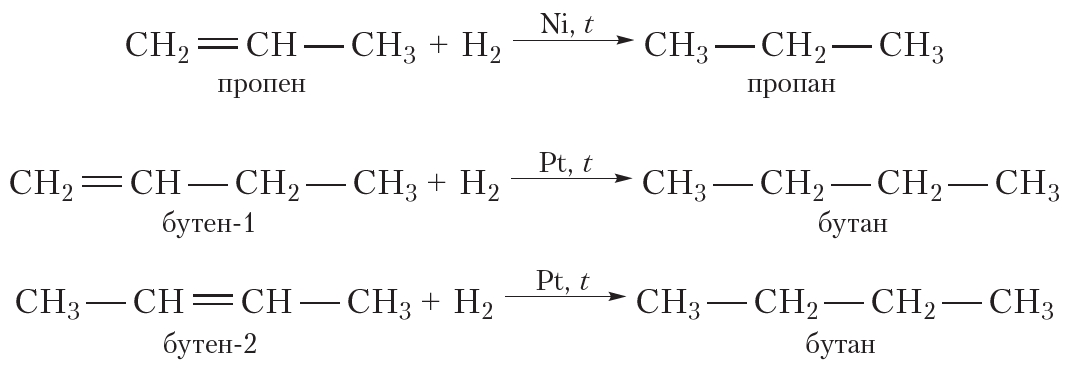
Как вы уже знаете, катализатор ускоряет протекание химической реакции, но сам при этом не расходуется. Роль катализатора в реакции гидрирования заключается в том, чтобы ослабить химическую связь в молекуле водорода и, таким образом, активировать эту молекулу для реакции присоединения:
3. Гидрогалогенирование. Присоединение галогеноводородов
Алкены могут вступать в реакции присоединения не только с простыми, но и со сложными веществами. Например, этилен легко присоединяет бромоводород:
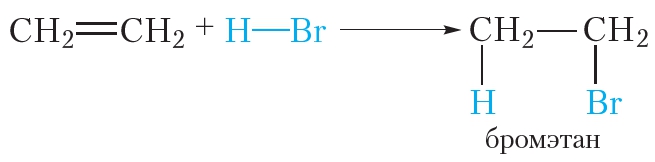
Реакции присоединения галогеноводородов к органическим веществам называются реакциями гидрогалогенирования. Эти реакции протекают при обычных условиях.
4. Гидратация. Присоединение воды
Гидратацией называется реакция присоединения воды к органическому веществу. При нагревании в присутствии катализатора (H2SO4) этилен присоединяет воду. При этом образуется этиловый спирт:
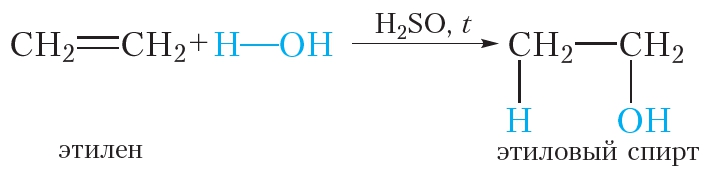
Реакция полимеризации
За счёт раскрытия двойных связей отдельные молекулы этилена могут соединяться друг с другом, образуя длинные цепи. Схематично этот процесс можно изобразить так:
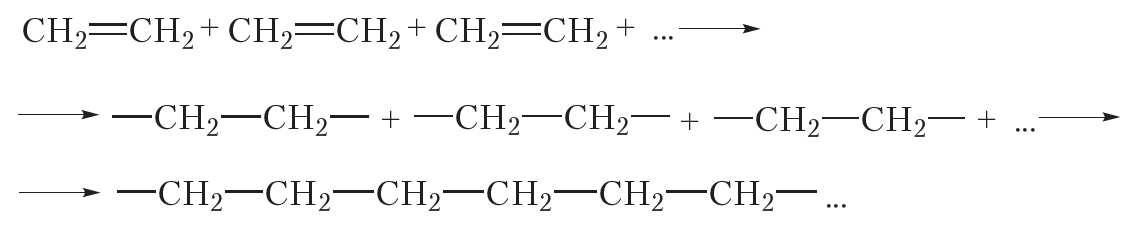
В результате соединения сотен или даже тысяч молекул этилена образуется одна гигантская молекула — полимер. Протекающая реакция называется реакцией полимеризации.
Более кратко процесс полимеризации этилена можно выразить следующим уравнением:
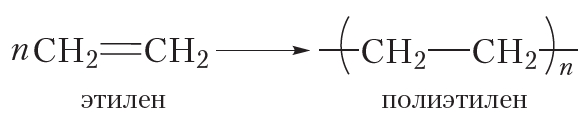
Полимеризоваться могут и другие алкены, в частности пропилен: 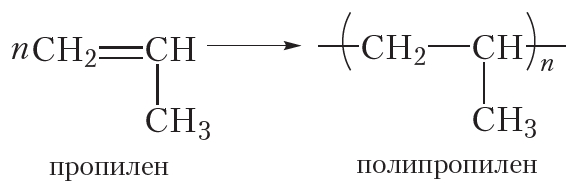
Исходное вещество в реакции полимеризации называется мономером, а продукт — полимером. Молекулы полимера также называют макромолекулами.
Число мономерных звеньев в молекуле полимера называется степенью полимеризации. В формуле полимера степень полимеризации обозначают индексом «n».
Полиэтилен и полипропилен нам хорошо знакомы. Из полиэтилена изготавливают полиэтиленовую плёнку, посуду, предметы домашнего обихода и т. д. Полипропилен очень похож на полиэтилен и отличается от него только повышенной прочностью и термостойкостью. Из полипропилена изготавливают плёнку для теплиц, корпуса автомобильных аккумуляторов и многое другое. Со многими полимерами вы познакомитесь далее.
Реакции окисления
1. Горение. Взаимодействие с кислородом
Так же, как и алканы, алкены горят с образованием углекислого газа и воды:
![]()
Приведём уравнение реакции горения алкенов в общем виде:
![]()
2. Неполное окисление. Реакция с KMnO4
Окисление алкенов может протекать и без разрушения углеродного скелета. Так, при пропускании этилена через разбавленный водный раствор перманганата калия (KMnO4) фиолетового цвета окраска исчезает. Перманганат калия расщепляет π-связь в молекуле этилена, при этом σ-связь между атомами углерода сохраняется. Протекание этой реакции отобразим не с помощью уравнения, а упрощённо в виде схемы. Схема реакции окисления этилена водным раствором перманганата калия выглядит следующим образом:
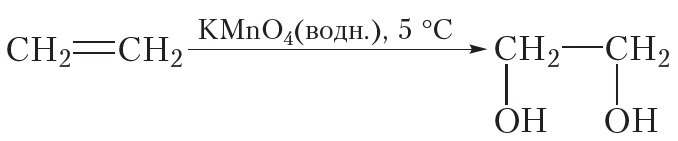
Из схемы видно, что π-связь в ходе данной реакции раскрывается, к атомам углерода присоединяются две кислородсодержащие группы — OH, то есть этилен окисляется. В результате образуется этиленгликоль, представитель многоатомных спиртов.
Качественные реакции
на двойную связь
Написание схем часто оказывается более удобным, чем уравнений, поэтому их широко используют в органической химии.
Так же, как и реакция с бромной водой, реакция с раствором перманганата калия является качественной реакцией на двойную связь. В результате данной реакции наблюдается обесцвечивание фиолетового раствора перманганата калия.
|
Характерными для алкенов являются реакции присоединения по двойной связи. При этом происходит расщепление π-связи. Алкены могут присоединять галогены, водород, галогеноводороды, воду. Реакция полимеризации — это многократно повторяющаяся реакция присоединения. В результате этой реакции образуются гигантские молекулы полимеров, широко применяемых в нашей жизни. Низкомолекулярное вещество, из которого синтезируют полимер, называется мономером; число мономерных звеньев в макромолекуле полимера называется степенью полимеризации. Реакции обесцвечивания бромной воды и раствора перманганата калия являются качественными реакциями на двойную связь. |
Вопросы и задания
1. Напишите уравнения реакций присоединения к этилену и пропилену: а) водорода; б) хлора. Назовите продукты реакций. Как на практике можно различить метан и этилен?
2. Напишите уравнение реакции бромоводорода с бутеном-2. Назовите продукт реакции.
3. К бромной воде добавили избыток раствора гексена-1 в гептане. Какие явления будут наблюдаться при этом? Напишите уравнение протекающей реакции.
4. Напишите схему реакции взаимодействия пропилена с водным раствором перманганата калия.
5. В результате полимеризации этилена получен полимер массой 140 г, содержащий 1,505 ∙ 1022 макромолекул. Вычислите: а) среднюю молярную массу полимера; б) степень полимеризации.
6. После пропускания через склянку с бромной водой (избыток) 20 дм3 (н. у.) смеси этана и этилена масса склянки увеличилась на 20 г. Определите объём (н. у.) этана в смеси газов.
7*. Напишите схемы реакций, с помощью которых можно получить 2,2,3,3-тетраметилбутан из 2-метилбутена.
 Вы можете познакомиться с особенностями протекания реакций присоединения к несимметричным алкенам, перейдя по ссылке в QR-коде.
Вы можете познакомиться с особенностями протекания реакций присоединения к несимметричным алкенам, перейдя по ссылке в QR-коде.