§ 6. Изотермический, изобарный и изохорный процессы
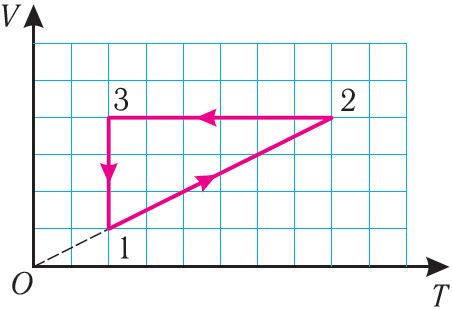
Пример 1. На рисунке 28 представлен график трёх процессов изменения состояния некоторой массы идеального газа. Как изменялись параметры газа на участках 1 2, 2
3, 3
1? Изобразите эти процессы в координатах (p, V) и (p, T).
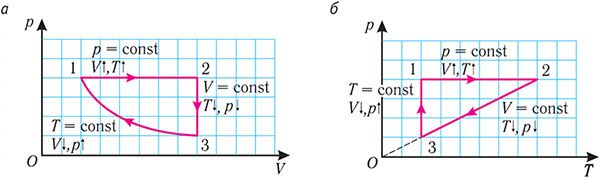
Решение. На участке 1 2 объём газа прямо пропорционален абсолютной температуре, следовательно, процесс перехода газа из состояния 1 в состояние 2 является изобарным. Из графика следует, что в состоянии 2 температура и объём газа больше в 4 раза, чем в состоянии 1. Следовательно, в процессе изобарного расширения некоторой массы газа из состояния 1 в состояние 2 температура и объём газа увеличились. Это можно записать таким образом:
переход ,
,
,
,
происходит изобарное нагревание газа.
В процессе перехода газа из состояния 2 в состояние 3 остаётся постоянным объём (процесс изохорный), а температура газа уменьшается в 4 раза. Из соотношения (6.3) следует, что при изохорном охлаждении давление газа уменьшается пропорционально его абсолютной температуре. Поэтому можно записать:
переход ,
,
,
происходит изохорное охлаждение газа.
Процесс перехода газа из состояния 3 в состояние 1 — изотермический. При этом объём газа уменьшается в 4 раза, что влечёт за собой, согласно закону Бойля–Мариотта, увеличение давления газа в 4 раза:
переход ,
,
происходит изотермическое сжатие газа.
Опираясь на сделанные выводы, представим все три процесса в координатах (p, V) и (p, T) (рис. 29, а, б).
Пример 2. При изотермическом расширении идеального газа определённой массы его объём увеличился от V1 = 2,0 л до V2 = 5,0 л, а давление уменьшилось на Δp = –15 кПа. Определите первоначальное давление газа.
V1 = 2,0 л = 2,0 · 10–3 м3
V2 = 5,0 л = 5,0 · 10–3 м3
Δp = –15 кПа = –1,5 · 104 Па
Решение: Так как температура и масса газа не изменяются, то его начальное и конечное состояния связаны законом Бойля–Мариотта, т. е. . С учётом того, что
, получим:
.
Откуда .
.
Ответ: .
![]()
Пример 3. В двух сосудах вместимостью V1 = 20 л и V2 = 30 л находятся химически не реагирующие идеальные газы, давления которых p1 = 1,0 МПа и p2 = 0,40 МПа соответственно. Определите давление газов в сосудах после того, как их соединили тонкой короткой трубкой. Температура газов до и после соединения сосудов одинаковая.
V1 = 20 л = 2,0 · 10-2 м3
V2 = 30 л = 3,0 · 10-2 м3
p1 = 1,0 МПа = 1,0 · 106 Па
p2 = 0,40 МПа = 4,0 · 105 Па
T = const
Решение: Давление смеси газов равно сумме парциальных давлений (закон Дальтона): . Найдём парциальное давление каждого газа после соединения сосудов. Так как температура и массы газов не изменяются, то начальное и конечное состояния каждого газа связаны законом Бойля–Мариотта, т. е.
,
.
Следовательно, парциальные давления газов после соединения сосудов: ,
. Тогда
.
Ответ: p = 0,64 МПа.