§ 32. Насычаныя аднаасноўныя карбонавыя кіслоты. Наменклатура. Ізамерыя. Фізічныя ўласцівасці
Фізічныя ўласцівасці
У табліцы 32.1 прыведзены формулы, назвы і тэмпературы кіпення некаторых карбонавых кіслот.
| Формула | Назва | tкіп, °С |
| H |
метанавая кіслата | 101 |
| CH3 |
этанавая кіслата | 118 |
| CH3 |
прапанавая кіслата | 141 |
| CH3 |
бутанавая кіслата | 164 |
| CH3 |
пентанавая кіслата | 185 |
Як бачна з даных табліцы, тэмпературы кіпення карбонавых кіслот значна вышэйшыя, чым у альдэгідаў з тым самым лікам атамаў вугляроду ў малекуле. У адрозненне ад альдэгідаў, сярод карбонавых кіслот няма газападобных пры пакаёвай тэмпературы рэчываў. Адсутнасць газападобных рэчываў мы ўжо сустракалі ў гамалагічным радзе аднаатамных спіртоў (§ 23). У параграфе 23 указана прычына высокіх тэмператур кіпення спіртоў — утварэнне паміж іх малекуламі вадародных сувязей. Утварэнне вадародных сувязей паміж малекуламі спіртоў магчыма дзякуючы наяўнасці палярных груп ![]() OH.
OH.
У малекулах карбонавых кіслот, як і ў спіртах, маецца група ![]() OH:
OH:
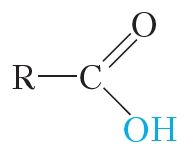
Таму паміж малекуламі карбонавых кіслот таксама ўтвараюцца вадародныя сувязі:
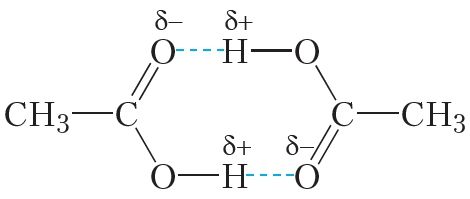
Вадародныя сувязі дастаткова моцна ўтрымліваюць малекулы карбонавых кіслот адну каля адной і робяць цяжкім пераход у газападобны стан, таму карбонавыя кіслоты маюць высокія тэмпературы кіпення.
Найпрасцейшыя прадстаўнікі карбонавых кіслот пры звычайных умовах уяўляюць сабой вадкасці з рэзкім пахам. З павелічэннем памеру вуглевадароднага радыкала тэмпературы кіпення карбонавых кіслот павялічваюцца. Вышэйшыя карбонавыя кіслоты — пальміцінавая і стэарынавая — цвёрдыя рэчывы.
Мурашыная, воцатная і прапанавая кіслоты змешваюцца з вадой у любых суадносінах, гэта значыць можна прыгатаваць водныя растворы гэтых кіслот любога саставу. Па меры павелічэння колькасці атамаў вугляроду ў вуглевадародным радыкале растваральнасць карбонавых кіслот у вадзе памяншаецца. Вышэйшыя карбонавыя кіслоты — пальміцінавая і стэарынавая — у вадзе нерастваральныя.
Па сістэматычнай наменклатуры карбаксільная група абазначаецца спалучэннем «-авая кіслата».
У адпаведнасці з сістэматычнай наменклатурай назва карбонавай кіслаты складаецца з назвы вуглевадароду з тым самым, што і ў кіслаты, лікам атамаў вугляроду ў малекуле і канчатка «-авая кіслата». Нумарацыю атамаў вугляроду галоўнага ланцуга пачынаюць з атама вугляроду карбаксільнай групы.
Паміж малекуламі карбонавых кіслот утвараюцца вадародныя сувязі, што абумоўлівае іх высокія тэмпературы кіпення.