§ 6. Структурныя формулы найпрасцейшых вуглевадародаў. Алканы. Ізамерыя алканаў
Структурныя формулы найпрасцейшых вуглевадародаў. Алканы. Ізамерыя алканаў
Найпрасцейшымі па саставе арганічнымі злучэннямі з’яўляюцца вуглевадароды. Малекулы вуглевадародаў складаюцца толькі з двух элементаў: вугляроду і вадароду. У сваю чаргу, найпрасцейшым вуглевадародам з’яўляецца метан. Малекулярная формула метану CH4. Малекулярная формула адлюстроўвае толькі састаў малекулы метану. Разгледзім будову малекулы метану.
Атам вугляроду мае чатыры валентныя электроны, атам вадароду — адзін. Гэта можна наглядна адлюстраваць пры дапамозе электронных формул:
![]()
Відавочна, што адзін атам вугляроду можа ўтварыць чатыры кавалентныя сувязі з чатырма атамамі вадароду:
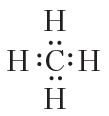
Пры гэтым атамы набываюць завершаныя знешнія электронныя абалонкі, вуглярод — васьміэлектронную, вадарод — двухэлектронную.
Прыведзеная электронная формула адлюстроўвае будову малекулы метану CH4, у якой цэнтральны атам вугляроду звязаны з чатырма атамамі вадароду з дапамогай чатырох агульных электронных пар (чатырох кавалентных сувязей). На практыцы пры адлюстраванні будовы малекул арганічных рэчываў зручней карыстацца структурнымі формуламі. Структурная формула метану:
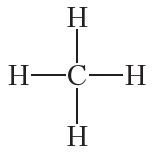
Структурныя формулы, у адрозненне ад малекулярных, адлюстроўваюць не толькі састаў, але і паслядоўнасць злучэння атамаў у малекуле.
Метан уяўляе сабой бясколерны гаручы газ без паху, нерастваральны ў вадзе. Тэмпература кіпення метану вельмі нізкая і складае –162 °С. Метан з’яўляецца асноўным кампанентам прыроднага газу. Акрамя гэтага, ён сустракаецца ў радовішчах каменнага вугалю, і яго раптоўныя выкіды бываюць прычынай пажараў у вугальных шахтах. Адсюль паходзіць назва метану «руднічны газ». Вылучэнні метану назіраюцца на тарфяных балотах, гэтым абумоўлена яшчэ адна яго назва — «балотны газ».
Саставім структурную формулу наступнага вуглевадароду — этану. Малекула этану змяшчае два атамы вугляроду, злучаныя адзінарнай сувяззю. Улічваючы, што вуглярод у арганічных рэчывах чатырохвалентны, лёгка скласці электронную і структурную формулы малекулы этану:
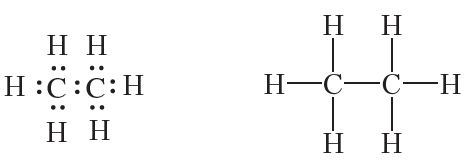
Малекулярная формула этану — C2H6. Этан, як і метан, бясколерны гаручы, нерастваральны ў вадзе газ. Тэмпература кіпення этану –89 °С. Этан сустракаецца ў прыродзе ў саставе прыроднага газу.
У арганічнай хіміі звычайна карыстаюцца структурнымі, а не малекулярнымі формуламі рэчываў. Для таго каб структурныя формулы не былі занадта грувасткімі, асобныя сувязі С ![]() Н у іх, як правіла, не паказваюць. У гэтым выпадку структурная формула этану будзе выглядаць больш кампактна: СН3
Н у іх, як правіла, не паказваюць. У гэтым выпадку структурная формула этану будзе выглядаць больш кампактна: СН3 ![]() СН3.
СН3.
Наступны вуглевадарод — прапан. Малекула прапану змяшчае ланцуг з трох атамаў вугляроду, злучаных адзінарнымі сувязямі. Структурныя формулы малекулы прапану:
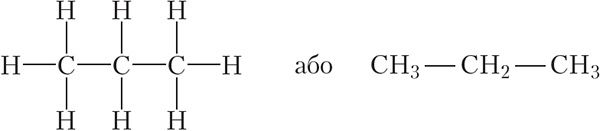
Падлічыўшы лік атамаў вугляроду і вадароду ў структурнай формуле прапану, можна запісаць яго малекулярную формулу — С3Н8. Прапан таксама, як метан і этан, з’яўляецца бясколерным гаручым газам, уваходзіць у састаў прыроднага газу.
З чатырох атамаў вугляроду можна пабудаваць два віды ланцугоў: нармальны (неразгалінаваны) і разгалінаваны. Структурныя формулы адпаведных вуглевадародаў:
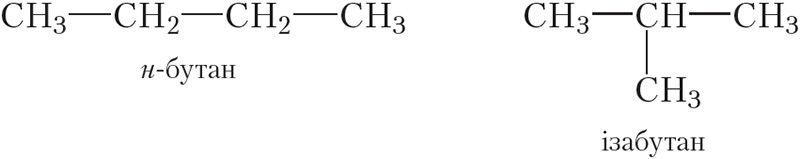

з бытавым газам
Нагадаем, што для абазначэння вуглевадародаў, якія маюць неразгалінаваны (нармальны) ланцуг, у пачатку назвы ставяць літару «н» (§ 5).
Як вы ўжо ведаеце з § 5, н-бутан і ізабутан з’яўляюцца ізамерамі. Малекулы гэтых рэчываў маюць аднолькавы якасны і колькасны састаў (малекулярная формула — C4H10), але розную будову.
Ізамерныя н-бутан і ізабутан пры нармальных умовах — бясколерныя газы без паху, прысутнічаюць у прыродным газе. Сумесямі прапану і ізамерных бутанаў, вылучанымі з прыроднага газу, запаўняюць газавыя балоны, якія выкарыстоўваюцца ў побыце (мал. 6.1).
З пяці атамаў вугляроду, злучаных адзінарнымі сувязямі, можна пабудаваць малекулы трох вуглевадародаў:
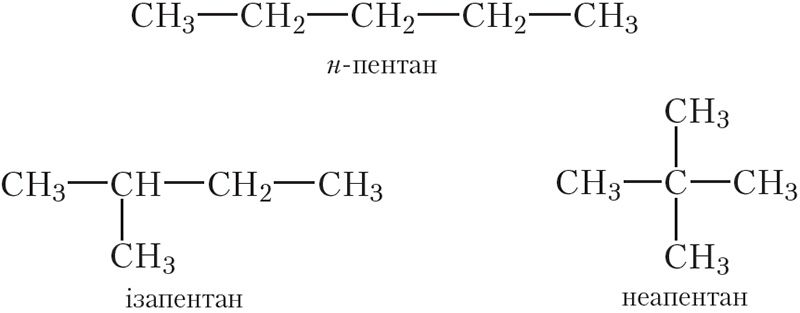
Састаў усіх трох вуглевадародаў аднолькавы і адпавядае малекулярнай формуле С5Н12. Гэта значыць, прыведзеныя вуглевадароды з’яўляюцца ізамерамі.
Відавочна, што для вуглевадародаў з большым лікам атамаў вугляроду ў малекуле лік ізамераў будзе вельмі значным. Так, напрыклад, ізамерных вуглевадародаў саставу С20Н42 налічваецца больш за 300 000, а лік магчымых ізамерных рэчываў саставу С40Н82 складае больш за 1012.
З’ява ізамерыі шмат у чым абумоўлівае разнастайнасць арганічных злучэнняў, робіць арганічную хімію сапраўды невычэрпнай.
Мы разгледзелі будову вуглевадародаў, у якіх атамы вугляроду звязаны паміж сабой толькі адзінарнымі сувязямі, астатнія сувязі атамы вугляроду ўтвараюць з атамамі вадароду. Састаў такіх вуглевадародаў апісваецца малекулярнымі формуламі СН4, С2Н6, С3Н8, С4Н10, С5Н12 і г. д. Відавочна, што для гэтых вуглевадародаў можна прапанаваць агульную формулу:
СnH2n+2
Усе вуглевадароды нецыклічнай будовы, у малекулах якіх маюцца толькі адзінарныя сувязі, будуць адпавядаць дадзенай агульнай формуле. Такія вуглевадароды называюцца алканамі.
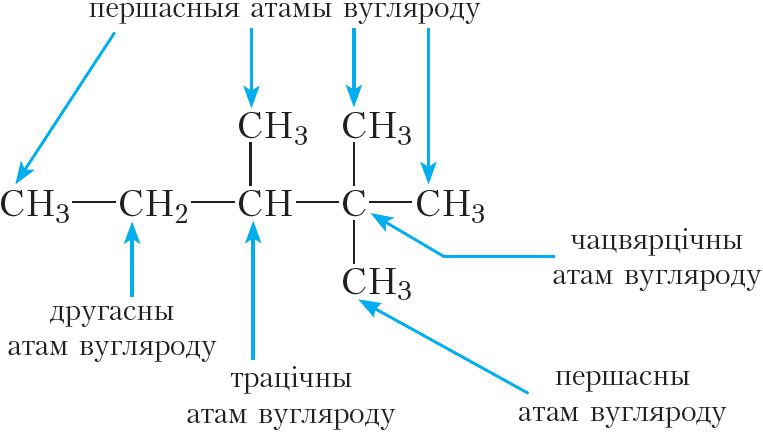
Атам вугляроду, звязаны ў вугляродным ланцугу толькі з адным атамам вугляроду, называецца першасным. Першасныя атамы вугляроду з’яўляюцца канцавымі элементамі вугляроднага ланцуга. У малекуле этану абодва атамы вугляроду першасныя.
Другасны атам вугляроду звязаны з двума атамамі вугляроду. У малекуле прапану першы і трэці атамы вугляроду з’яўляюцца першаснымі, другі атам — другасным.
Трацічны атам вугляроду звязаны з трыма атамамі вугляроду; чацвярцічны — з чатырма атамамі вугляроду. Трацічныя і чацвярцічныя атамы вугляроду з’яўляюцца кропкамі разгалінавання вугляроднага ланцуга. Такія атамы вугляроду маюцца ў малекулах ізапентану і неапентану (укажыце іх самастойна).
Вуглевадароды нецыклічнай будовы, у малекулах якіх маюцца толькі адзінарныя сувязі, называюцца алканамі.
Агульная формула алканаў CnH2n+2.
Існуюць два ізамерныя алканы саставу С4Н10 і тры ізамерныя алканы саставу С5Н12.