§ 48. Алюміній і яго злучэнні
Алюміній як хімічны элемент

Алюміній — элемент 3-га перыяду, IIIA-групы. Электронная схема, формула электроннай канфігурацыі і электронна-графічная схема яго атама маюць выгляд:
13Al ![]() або 13Аl 2е–, 8е–, 3е–;
або 13Аl 2е–, 8е–, 3е–;
13Аl 1s22s22p63s23p1 або 13Аl [Ne]3s23p1;
13Al 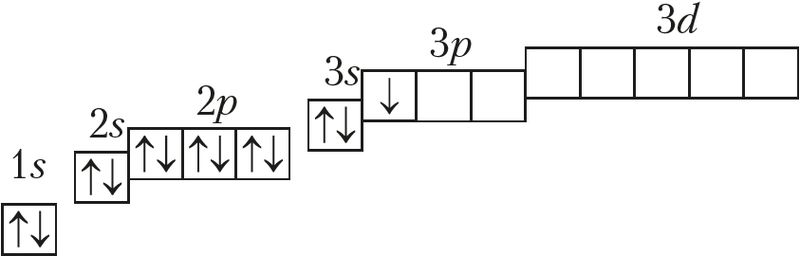
На знешнім электронным слоі ў атамаў алюмінію знаходзіцца тры электроны, канфігурацыя валентнасці слоя 3s23p1, гэта значыць алюміній адносіцца да р-элементаў. Ён мае нізкае значэнне электраадмоўнасці χ(Al) = 1,6 і праяўляе ў злучэннях ступень акіслення толькі +3.
Алюміній — самы распаўсюджаны метал у зямной кары (ω(Al) = 7,5 %, (§ 43, мал. 102). У прыродзе ён прадстаўлены адзіным нуклідам .
З прычыны значнай хімічнай актыўнасці алюміній у прыродных умовах знаходзіцца пераважна ў выглядзе хімічных злучэнняў — мінералаў, якія ўяўляюць сабой аксіды, гідраксіды, сілікаты або алюмасілікаты. Напрыклад, прадукт разбурэння горных парод — гліна (каалін), прадукты далейшага разбурэння гліны — баксіты Al2O3 · xH2O. Найбольшае практычнае значэнне для атрымання алюмінію маюць баксіты і крыаліт Na3[AlF6].