§ 35. Серная кіслата
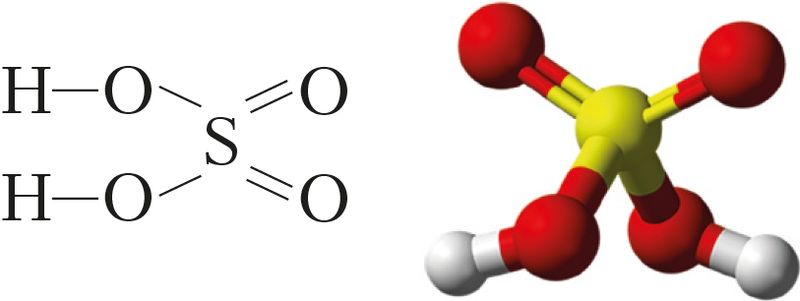
Серная кіслата Н2SO4 — найважнейшая з мінеральных кіслот.
Гэта рэчыва малекулярнай будовы. Са структурнай формулы відаць, што серная кіслата з’яўляецца гідраксідам і адносіцца да двухасноўных кіслот (мал. 83).
Прамысловае атрыманне сернай кіслаты — многастадыйны працэс, сыравіна для яго — гэта пірыт (жалезны або серны калчадан) FeS2 і іншыя сульфідныя руды, сера S, серавадарод H2S (з нафты), адкіды металургічнай вытворчасці. Схема атрымання кіслаты з пірыту выглядае так:
Як відаць, працэс уключае тры стадыі, якія паказваюцца наступнымі ўраўненнямі рэакцый:
На трэцяй стадыі аксід серы(VI) SO3 у паглынальнай вежы арашаецца канцэнтраванай сернай кіслатой з масавай доляй кіслаты 96–98 % (гэта значыць утрыманне вады ўсяго 2–4 %). Пры гэтым атрымліваюць раствор аксіду серы(VI) у сернай кіслаце (олеум). Ваду для паглынання SO3 не выкарыстоўваюць, бо з-за вылучэння вялікай колькасці цеплаты ўтвараецца «сернакіслотны туман», які цяжка скандэнсаваць.
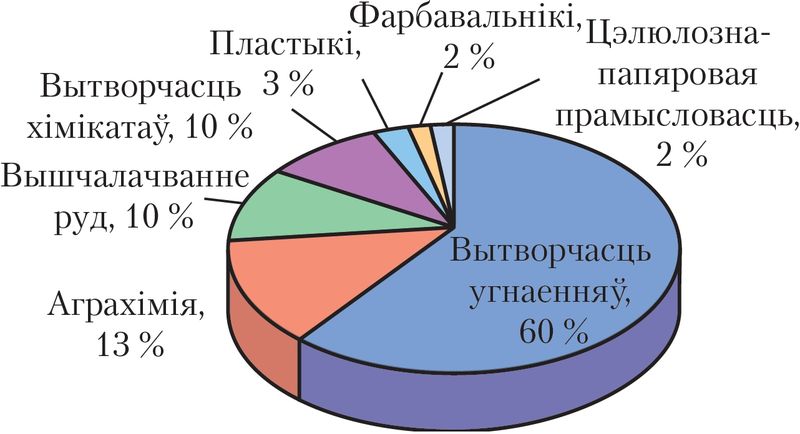
Сусветная вытворчасць сернай кіслаты — каля 200 млн тон за год. Самы буйны спажывец сернай кіслаты — вытворчасць мінеральных угнаенняў. Акрамя таго, яна выкарыстоўваецца для атрымання розных мінеральных кіслот і солей, хімічных валокнаў, фарбавальнікаў, выбуховых рэчываў, у прамысловым арганічным сінтэзе, у нафтавай, металаапрацоўчай, тэкстыльнай, гарбарнай, харчовай і іншых галінах прамысловасці (мал. 84), як электраліт у свінцовых акумулятарах (мал. 85).