§ 10. Перыядычны закон у святле тэорыі будовы атама
*Становішча ў перыядычнай сістэме d- і f-элементаў
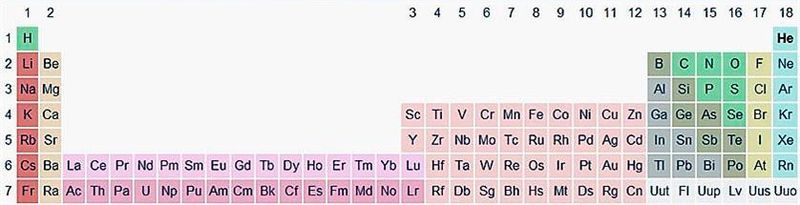
d- і f-Элементы адносяць да элементаў B-груп. Бо гэтыя элементы размешчаны ў перыядычнай сістэме паміж s- і p-элементамі ў 4–8-м перыядах, іх называюць пераходнымі.
У 4-м перыядзе (K — Kr) змяшчаецца 18 элементаў. З прычыны большай колькасці элементаў у гэтым перыядзе ў параўнанні з першымі трыма перыядамі Д. І. Мендзялееў назваў 4-ы і наступныя перыяды вялікімі.
Пяты перыяд (Rb — Xe) пабудаваны аналагічна 4-му: у ім таксама знаходзіцца дзесяць пераходных d-элементаў (Y — Cd).
Шосты перыяд (Cs — Rn) змяшчае 32 элементы. У яго, акрамя дзесяці d-элементаў (Lu — Hg), уключана 14 f-элементаў. Элементы ад лантану (La) да ітэрбію (Yb) у выглядзе асобнага раду вынесены ўніз табліцы, рад атрымаў назву «лантаноіды» па яго першым элеменце — лантане. Лантаноіды падобныя хімічнымі ўласцівасцямі. Гэта тлумачыцца тым, што электронамі ў іх запаўняюцца ўнутраныя 4f-арбіталі, а валентны электронны слой мае падобную электронную канфігурацыю — часцей за ўсё 5d16s2. У злучэннях лантаноіды праяўляюць пераважна ступень акіслення +3.
Сёмы перыяд таксама змяшчае 32 элементы — ад францыю (Fr) да аганесону (Og). Перыяд пачынаецца з s-элементаў (Fr і Ra), потым ідуць 14 актыноідаў (Ac — No). Гэтыя элементы таксама вынесены ў асобны рад унізе табліцы з-за блізкасці іх уласцівасцей, хоць яны выражаныя менш, чым у лантаноідаў. Потым ідуць дзесяць 6d-элементаў і шэсць 6р-элементаў. Усе элементы гэтага перыяду з’яўляюцца радыеактыўнымі, і вялікая іх частка атрымана штучным шляхам.
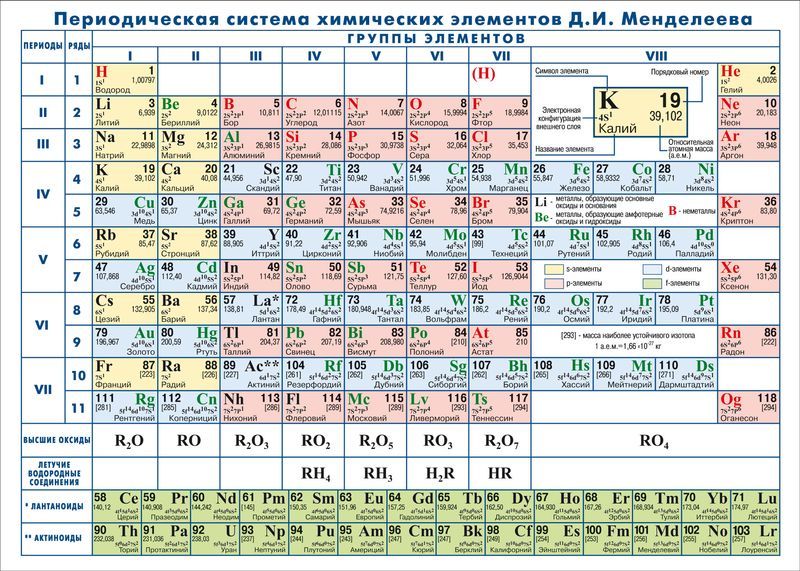
У перыядычнай сістэме элементы падзелены на групы. Дзве групы IA і IIA запаўняюць s-элементы. Далей размяшчаюцца дзесяць В-груп, запоўненых d-элементамі. Завяршаюць табліцу шэсць А-груп, якія змяшчаюць р-элементы.
Ці можа быць адкрыта яшчэ больш хімічных элементаў, чым вядома цяпер? Бо самыя апошнія з вядомых элементаў былі адкрыты зусім нядаўна.
На гэтае пытанне адказвае тэорыя ядзернай фізікі. Пакуль з надзейнасцю прадказваюць магчымасць існавання хімічных элементаў з парадкавымі нумарамі да 126. У той самы час ёсць навуковыя канцэпцыі, якія бачаць магчымым штучнае атрыманне хімічных элементаў з парадкавымі нумарамі да 173 з «астраўком стабільнасці» ў раёне 164-га элемента.
У перыядычнага закону няма звыклага для фізічных законаў матэматычнага выразу. Усе неаднаразовыя спробы вывесці матэматычную формулу перыядычнага закону былі марнымі. У гэтым асаблівасць уласцівасцей хімічных элементаў і іх злучэнняў. Іх уласцівасці не ўкладваюцца ў простыя матэматычныя выразы.
Своеасаблівай графічнай формай, якая паказвае перыядычны закон, стала перыядычная сістэма, якую Д. І. Мендзялееў прадставіў у выглядзе табліцы. На прапанову ІЮПАК яе так і называюць: «Перыядычная табліца элементаў» (Periodic Table of the Elements), а ў нас часта коратка: «Табліца Мендзялеева».
Табліца перыядычнай сістэмы — гэта ілюстрацыя заканамернага размяшчэння хімічных элементаў адносна адзін аднаго ў перыядычнай сістэме.
Мендзялееў палічыў больш прымальным прадставіць перыядычную сістэму ў кароткаперыяднай форме, якая ў сучасным выглядзе паказана на малюнку 20.1. У ёй групы элементаў падзяляюцца на падгрупы — галоўныя і пабочныя. У галоўных падгрупах размешчаны s- і p-элементы, у пабочных — d-элементы.
Пазней ІЮПАК прапанаваў выкарыстоўваць паўдоўгаперыядны варыянт табліцы, у якім галоўныя і пабочныя падгрупы былі ператвораны ў асобныя А- і В-групы: галоўныя — у А-групы, пабочныя — у В-групы. Такіх груп аказалася 18. Гэтая табліца размешчана на форзацы падручніка.
Існуе варыянт доўгаперыяднай табліцы, у якой f-элементы ўбудаваны ў рад з d-элементамі (мал. 20.2). Існуюць і іншыя варыянты малюнка перыядычнай сістэмы, іх налічваецца каля 500.