§ 15. Валентность и степень окисления
Степень окисления
В случае веществ с ионными или полярными связями для характеристики состояния атомов, образующих эти связи, используют понятие степень окисления. Как вы уже знаете из материала параграфа § 11, степень окисления атома — это условный заряд, который приписывают атому в предположении, что он образует с соседними атомами только ионные связи.
Численное значение степени окисления атома в конкретном соединении определяют по количеству электронов, смещённых при образовании связи или переданных соседним атомам. Так, cтепень окисления атомов азота в молекулах простого вещества ![]() равна 0 (электроны не смещены, связь ковалентная неполярная). В молекуле аммиака азот проявляет степень окисления –3, так как к атому азота сместились три электрона от атомов водорода. Атомы водорода при этом имеют степень окисления +1.
равна 0 (электроны не смещены, связь ковалентная неполярная). В молекуле аммиака азот проявляет степень окисления –3, так как к атому азота сместились три электрона от атомов водорода. Атомы водорода при этом имеют степень окисления +1.
При вычислениях учитывают, что алгебраическая сумма степеней окисления всех атомов в соединении равна 0.
Не следует забывать, что атомы некоторых элементов имеют постоянное значение степени окисления в своих соединениях (,
,
,
и др.). Наиболее электроотрицательные атомы в конкретном соединении обычно имеют низшую степень окисления.
Так, в молекуле CF4 более электроотрицателен фтор, его атомы имеют степень окисления –1. Следовательно, углерод находится в степени окисления +4, то есть .
В перманганате калия KMnO4 калий имеет постоянную степень окисления, кислород как наиболее электроотрицательный элемент находится в низшей степени окисления –2, поэтому степень окисления марганца можно найти из равенства 0 = (+1) + х + 4(–2), то есть .
Во многих ковалентных соединениях абсолютная величина степени окисления элементов равна их валентности. Например, азот в молекуле аммиака имеет валентность 3 и степень окисления –3. В случае ионных соединений атомов металлов с р-элементами V–VII-групп используют понятие «степень окисления». Например, в хлориде кальция СаCl2 степень окисления хлора –1, а кальция — +2.
Валентность может отличаться от степени окисления. Это характерно, например, для простых веществ, в молекулах которых степень окисления атомов всегда равна нулю, а валентность — числу общих электронных пар.
Так, в молекуле кислорода валентность кислорода равна 2, а степень окисления 0. В качестве другого примера приведём молекулу пероксида водорода
. В ней кислород двухвалентен, а водород одновалентен. В то же время степени окисления обоих элементов по абсолютной величине равны 1:
. Не совпадают значения степени окисления и валентности азота в ионе аммония (–3, 4)
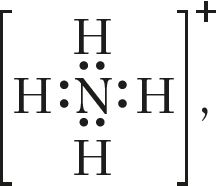 молекуле азотной кислоты (+5, 4)
молекуле азотной кислоты (+5, 4) .
Степень окисления атомов определяет характер возможных химических взаимодействий с участием этих атомов. Так, элемент в низшей степени окисления (в данном случае азот в степени окисления –3) может выступать только как восстановитель:
Элемент в высшей степени окисления (азот, +5) может быть только окислителем:
В промежуточной степени окисления элемент (азот, +2) может быть как окислителем, так и восстановителем:
(азот — восстановитель, окисляется);
(азот — окислитель, восстанавливается).
Высшая степень окисления атомов А-групп равна номеру группы (за исключением благородных газов, фтора и кислорода). Низшая, отрицательная, степень окисления равна номеру А-группы минус 8.