§ 14.1. Гибридизация атомных орбиталей
Изучая строение молекул органических веществ, вы узнали, что все молекулы имеют определённое пространственное строение. Это является следствием направленности ковалентных связей. Ковалентные связи располагаются в пространстве в направлении максимального перекрывания электронных облаков. Угол между связями — валентный угол — зависит от числа атомных орбиталей данного атома, принимающих участие в образовании σ-связей.
Для объяснения и предсказания пространственного строения молекул как органических, так и неорганических веществ, а также сложных ионов (например, ,
) используют представление о гибридизации атомных орбиталей.
Термин гибрид вам известен из биологии и означает организм, полученный вследствие скрещивания. По аналогии с этим в теории химической связи вводят понятие гибридная орбиталь. Она рассматривается как результат своеобразного «скрещивания» разных по форме, но близких по энергии атомных орбиталей.
Теоретические представления о гибридизации атомных орбиталей построены на следующих положениях.
1. При образовании ковалентных σ-связей исходные валентные s- и p-орбитали приобретают одинаковую форму и энергию, превращаясь в гибридные орбитали.
Гибридизацией называют перераспределение электронной плотности орбиталей свободного атома при образовании молекулы с формированием гибридных орбиталей.
2. Гибридные орбитали похожи друг на друга и отличаются от исходных s- и p-орбиталей своей энергией и формой электронного облака. В результате гибридизации энергия гибридных атомных орбиталей выравнивается. Гибридные орбитали более вытянуты в пространстве в сторону соседних атомов. Это обеспечивает их более полное перекрывание с атомными орбиталями соседних атомов и, соответственно, более прочные связи с ними.
3. В гибридизации участвуют разные по форме, но близкие по энергии атомные орбитали. Это означает, что в гибридизации могут принимать участие, например, 2s-орбиталь с 2p-орбиталью, но не 1s-орбиталь с 2p-орбиталью.
4. Число образующихся гибридных орбиталей равно суммарному числу исходных орбиталей, принимающих участие в гибридизации.
5. Гибридные орбитали участвуют в образовании только σ-связей.
6. π-Связи образуются за счёт бокового перекрывания негибридных орбиталей.
7. Гибридные орбитали располагаются в пространстве на максимальном удалении друг от друга.
8. В гибридизации принимают участие не только орбитали, которые образуют σ-связи, но и s- и р-орбитали с неподелённой парой электронов того же энергетического уровня. Гибридные орбитали с неподелённой парой электронов занимают больший объём, чем связывающая пара электронов между двумя атомами. По этой причине неподелённые пары обладают максимальной отталкивающей силой, что приводит к уменьшению валентного угла между орбиталями со связывающими электронами.
Различают несколько типов гибридизации. Каждому из них соответствует определённая ориентация гибридных орбиталей в пространстве (табл. 12.1).
Так, если атом образует две σ-связи за счёт его одной s- и одной p-орбиталей, то образуется две sp-гибридные орбитали, которые ориентированы друг к другу под углом 180°. Такой тип гибридизации называют sp-гибридизацией.
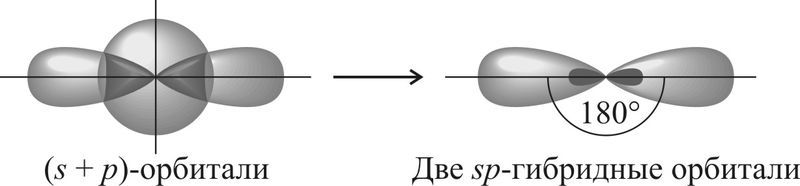
Если атом образует три σ-связи за счёт его одной s- и двух p-орбиталей, то угол между образующимися тремя sp2-гибридными орбиталями составляет 120°. Такой тип гибридизации называют sp2-гибридизацией.
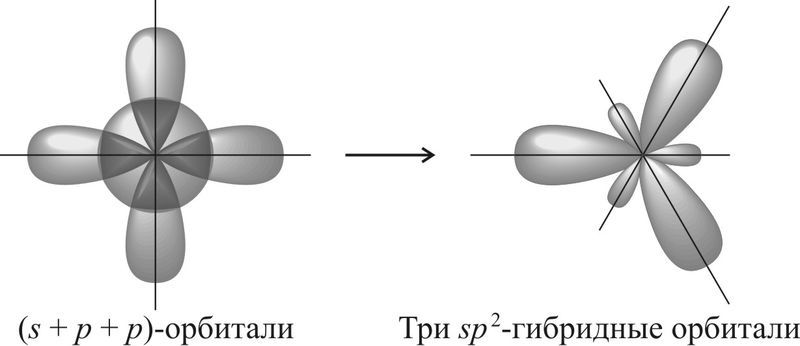
Если атом образует четыре σ-связи за счёт его одной s- и трёх p-орбиталей, то угол между образующимися четырьмя sp3-гибридными орбиталями составляет 109,5°. Такой тип гибридизации называют sp3-гибридизацией.
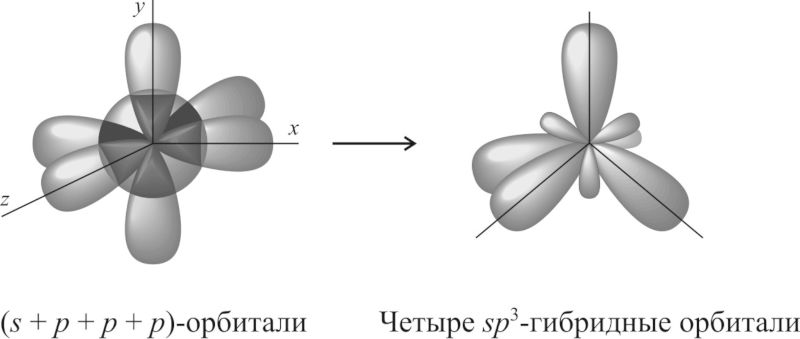
У элементов 3-го и последующих периодов в образовании гибридных атомных орбиталей могут принимать участие и d-орбитали.
Таким образом, расположение в пространстве гибридных орбиталей определяет углы между σ-связями, то есть пространственное строение молекул и сложных ионов.
Характеристики различных типов гибридизации и примеры молекул и сложных ионов, пространственное строение которых отвечает этим типам гибридизации, приведены в таблице 12.1.
Таблица 12.1. Характеристики sp-, sp2- и sp3-гибридизации валентных орбиталей центрального атома
| Исходные атомные орбитали | Число гибридных орбиталей | Тип гибридизации | Валентный угол* | Геометрическая фигура, отвечающая типу гибридизации центрального атома, и форма структурных единиц | Примеры |
|---|---|---|---|---|---|
| s + p | Две | sp | 180° |
 |
|
| s + p + p | Три | sp2 | 120° |
 |
 |
| s + p + p + p | Четыре | sp3 | 109,5° |
 |
* Указан идеальный валентный угол. В реальных структурах вследствие отталкивания неподелённых электронных пар валентный угол может отклоняться от идеального.
Рассмотрим, как можно использовать представление о гибридизации атомных орбиталей для предсказания и объяснения формы молекул неорганических веществ.
Пример 1. Валентный угол в молекуле аммиака составляет 107, а ионе аммония — 109,5°. Используя представление о гибридизации атомных орбиталей атома азота, объясните наблюдаемые различия в значениях валентных углов в NH3 и .
Решение
В молекуле аммиака азот является центральным атомом и образует три ковалентные связи с атомами водорода по обменному механизму. Если бы в образовании ковалентных связей участвовали исходные гантелеобразные р-орбитали азота, то угол между связями должен был составлять 90°. Объяснить действительный валентный угол в аммиаке можно, если использовать представление о гибридизации атомных орбиталей.
У атома азота на валентном слое имеется три неспаренных электрона на р-орбиталях и пара электронов на s-орбитали. При образовании химических связей все эти орбитали (s + 3p) подвергаются гибридизации с образованием четырёх sp3-гибридных орбиталей, которые в идеальном случае должны были бы располагаться по вершинам тетраэдра под углом друг к другу в 109,5°.
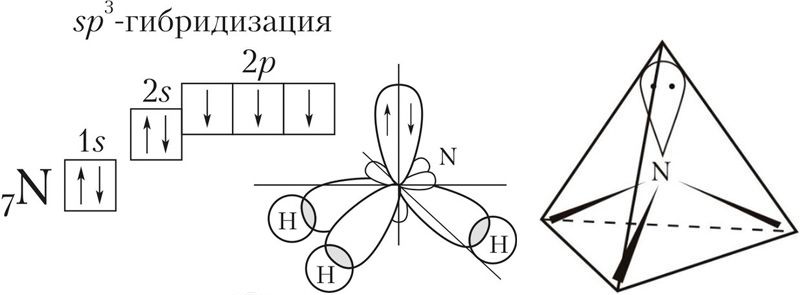
Однако, из-за того что на одной из гибридных орбиталей имеется неподелённая пара электронов, которая отталкивает орбитали со связывающими электронами, валентный угол уменьшается до 107.
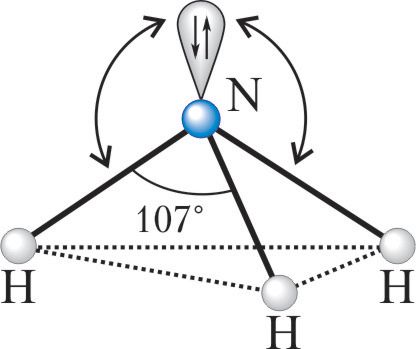
В связи с тем что орбиталь с неподелённой парой электронов не входит в описание взаимного расположения атомов, принято говорить, что молекула аммиака имеет форму треугольной пирамиды с основанием в виде правильного треугольника из атомов Н—Н—Н и вершиной — атомом N.
При присоединении к молекуле аммиака катиона водорода искажение валентных углов устраняется.

Пример 2. В соответствии с экспериментальными данными валентный угол Н—O—Н в молекуле воды составляет 104,5°, то есть молекула воды имеет угловое строение. Используя представление о гибридных орбиталях, объясните пространственное строение молекулы воды.
Решение
В молекуле воды центральный атом кислорода образует две σ-связи с атомами водорода. Остальные электроны кислорода, расположенные на валентном электронном слое, образуют две неподелённые пары. В этом случае можно говорить об образовании четырёх гибридных орбиталей (s + 3p) и, соответственно, о sp3-гибридизации орбиталей атома кислорода.
Как и в случае молекулы аммиака, гибридные орбитали ориентированы по углам тетраэдра, однако орбитали с двумя неподелёнными парами электронов отталкивают пары электронов, образующих химические связи О—Н. Это уменьшает валентный угол Н—O—Н. Он становится равным 104,5°, то есть меньше тетраэдрического (109,5°):
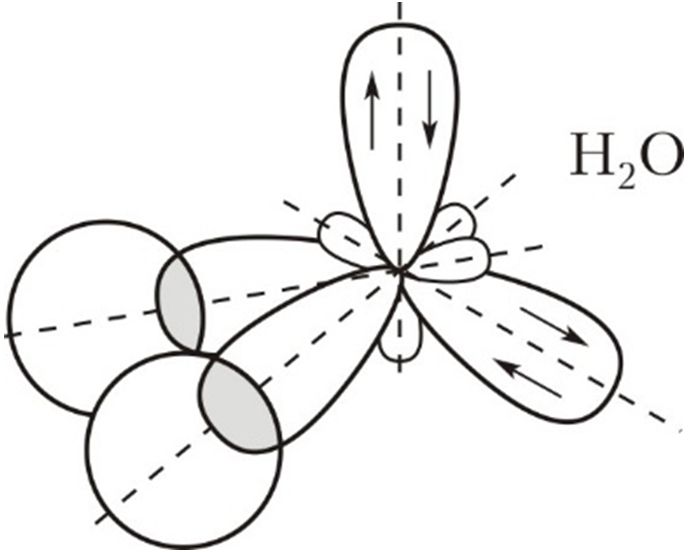
Неподелённые пары электронов не во всех соединениях обладают сильным отталкивающим действием на электроны химической связи. Например, в спиртах валентный угол Н—O—C составляет 107–109° и мало отличается от тетраэдрического. В молекуле серной кислоты угол Н—O—S тоже составляет 108,5° и также мало отличается от тетраэдрического. В простых эфирах, например H3C—O—CH3, угол C—O—C составляет 109–112° и также близок к тетраэдрическому.
При определении пространственного строения молекул всегда надо помнить, что, как всякое модельное представление, понятие о гибридизации имеет ограниченную область применения. Если при определении формы молекул, образуемых элементами 2-го периода, гибридизация даёт хороший прогноз, то для элементов периодов с большими номерами её предсказательные возможности не всегда совпадают с экспериментальными данными. Например, в молекулах воды и сероводорода атомы кислорода и серы, с точки зрения возможного типа гибридизации, должны находиться в состоянии sp3-гибридизации. Однако в молекуле воды валентный угол близок к тетраэдрическому, а в молекуле сероводорода он составляет 92°. Тем не менее валентный угол в молекуле H3C—S—H составляет уже 99,5°, в молекуле Cl—S—Cl — 103°, а у циклической молекулы S8 угол S—S—S равен 108°, что весьма близко к 109,5°.